cho dung dịch CaCl2 vào 50g dung dịch AgNO3 có nồng độ 17%. Sau khi phản ứng kết thúc, hãy tính
a) khối lượng CaCl2 tham gia phản ứng.
b) khối lượng kết tủa tạo thành.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(2AgNO_3+CaCl_2\rightarrow Ca\left(NO_3\right)_2+2AgCl\downarrow\)
Ta có: \(n_{AgNO_3}=\dfrac{1,7}{170}=0,01\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{AgCl}=0,01\left(mol\right)\\n_{CaCl_2}=n_{Ca\left(NO_3\right)_2}=0,005\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{CaCl_2}=0,005\cdot111=0,555\left(g\right)\\m_{AgCl}=0,01\cdot143,5=1,435\left(g\right)\\C_{M_{Ca\left(NO_3\right)_2}}=\dfrac{0,005}{0,07+0,03}=0,05\left(M\right)\end{matrix}\right.\)

ta có: mCaCl2= 7,4. 45%= 3,33( g)
\(\Rightarrow\) nCaCl2= \(\dfrac{3,33}{111}\)= 0,03( mol)
PTPU
CaCl2+ 2AgNO3\(\rightarrow\) Ca(NO3)2+ 2AgCl\(\downarrow\)
..0,03........0,06.............0,03............0,06.......... mol
\(\Rightarrow\) mAgNO3= 0,06. 170= 10,2( g)
\(\Rightarrow\) mdd AgNO3= \(\dfrac{10,2}{50\%}\)= 20,4( g)
ta có: mdd sau pư= mdd CaCl2+ mdd AgNO3- mAgCl
= 7,4+ 20,4- 0,06. 143,5
= 19,19( g)
có: mCa(NO3)2= 0,03.164= 4,92( g)
\(\Rightarrow\) C%Ca(NO3)2= \(\dfrac{4,92}{19,19}\). 100%\(\approx\) 25,64%

PTHH: \(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
Ta có: \(n_{NaCl}=0,2\cdot0,5=0,1\left(mol\right)=n_{AgNO_3}=n_{AgCl}\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{AgNO_3}}=\dfrac{0,1}{0,4}=0,25\left(M\right)\\m_{AgCl}=0,1\cdot143,5=14,35\left(g\right)\end{matrix}\right.\)

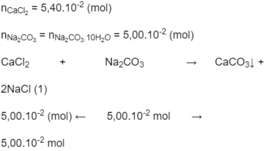
Hỗn hợp thu được gồm có C a C O 3 , NaCl và C a C l 2 dư
Khi cho C O 2 ( n C O 2 = 6,70. 10 - 2 ) vào hỗn hợp, xảy ra phản ứng:
C O 2 + C a C O 3 + H 2 O → C a ( H C O 3 ) 2 (2)
Theo (2), số mol C a C O 3 bị hòa tan = số mol C O 2 phản ứng = 4,02. 10 - 2 (mol)
Khối lượng kết tủa C a C O 3 thu được là:
(5,00. 10 - 2 - 4,02. 10 - 2 ) x 100 = 0,98 (g).

\(n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
a) Pt : \(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl|\)
1 2 1 2
0,25 0,5 0,25
b) \(n_{Fe\left(OH\right)2}=\dfrac{0,5.1}{2}=0,25\left(mol\right)\)
⇒ \(m_{Fe\left(OH\right)2}=0,25.90=22,5\left(g\right)\)
c) \(n_{FeCl2}=\dfrac{0,5.1}{2}=0,25\left(mol\right)\)
100ml = 0,1l
\(C_{M_{ddFeCl2}}=\dfrac{0,25}{0,1}=2,5\left(M\right)\)
d) Pt : \(Fe\left(OH\right)_2\underrightarrow{t^o}FeO+H_2O|\)
1 1 1
0,25 0,25
\(n_{FeO}=\dfrac{0,25.1}{1}=0,25\left(mol\right)\)
⇒ \(m_{FeO}=0,25.72=18\left(g\right)\)
Chúc bạn học tốt

a)
$BaCl_2 + Na_2SO_4 \to BaSO_4 + 2NaCl$
$n_{BaCl_2} = 0,01 = n_{Na_2SO_4} = 0,01 \Rightarrow $ Vừa đủ
$n_{BaSO_4} = n_{Na_2SO_4} = 0,01(mol)$
$m_{BaSO_4} = 0,01.233 = 0,233(gam)$
b)
$n_{NaCl} = 2n_{Na_2SO_4} = 0,02(mol)$
$V_{dd} = 0,1 + 0,2 = 0,3(lít)$
$C_{M_{NaCl}} = \dfrac{0,02}{0,3} = 0,067M$
c)
$[Na^+] = [Cl^-] = C_{M_{NaCl}} = 0,067M$
\(n_{BaCl_2}=0.1\cdot0.1=0.01\left(mol\right)\)
\(n_{Na_2SO_4}=0.2\cdot0.05=0.01\left(mol\right)\)
\(BaCl_2+Na_2SO_4\rightarrow BaSO_4+2NaCl\)
\(0.01..........0.01............0.01..............0.02\)
\(m_{BaSO_4}=0.01\cdot233=2.33\left(g\right)\)
\(C_{M_{NaCl}}=\dfrac{0.01}{0.1+0.2}=0.03\left(M\right)\)
\(\left[Na^+\right]=\left[Cl^-\right]=0.03\left(M\right)\)