Cho hỗn hợp 2 kim loại Fe và Cu tác dụng với khí clo dư thu được 59,5 gam hỗn hợp muối. Cũng lượng hỗn hợp trên cho tác dụng với lượng dư dung dịch HCl 10% thu được 25,4 gam một muối. Tính phần trăm khối lượng mỗi muối trong hỗn hợp muối thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


m axit cần dùng = 0,2 x 2 x 36,5 = 14,6g
m dung dịch HCl = 146g => V dd HCl = 146/1 = 146ml

Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y.
2Fe + 3Cl2 → 2FeCl3 (1)
x(mol) x(mol)
Cu + Cl2 → CuCl2 (2)
y(mol) y(mol)
Fe + 2HCl → FeCl2 + H2 (3)
x (mol) 2x(mol) x(mol).
Theo điều kiện bài toán và phương trình hoá học (3) ta có: 127x = 25,4 → x = 0,2
Theo phương trình phản ứng (1) và (2) ta có: 162,5x + 135y = 59,5
Vậy y = 0,2.
Khối lượng mỗi muối là: m FeCl3=32,5gam
m CuCl2=27gam
%FeCl3 = 54,62%.
%CuCl2 = 45,38%

a) Gọi x,y lần lượt là số mol Fe, Cu trong hhX (x,y>0) (mol)
- Khi cho X t/d hoàn toàn với khí Clo dư:
\(2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ Cu+Cl_2\rightarrow\left(t^o\right)CuCl_2\\ \Rightarrow162,5x+135y=59,5\left(1\right)\)
- Khi cho X tác dụng hoàn toàn với dd HCl 36,5%. Cu sẽ không tác dụng mà chỉ có Fe tham gia phản ứng.
\(Fe+2HCl\rightarrow FeCl_2+H_2\\ m_{FeCl_2}=127x=25,4\left(g\right)\left(2\right)\\ \left(1\right),\left(2\right)\Rightarrow\left\{{}\begin{matrix}162,5x+135y=59,5\\127x=25,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\\ \Rightarrow a=m_{hhX}=m_{Fe}+m_{Cu}=64x+56y=64.0,2+56.0,2=24\left(g\right)\)
Tính phần trăm mỗi muối sau phản ứng chắc ở phản ứng với Clo dư.
\(\%m_{FeCl_3}=\dfrac{0,2.162,5}{0,2.162,5+0,2.135}.100\approx54,622\%\\ \Rightarrow\%m_{CuCl_2}\approx45,378\%\)
b)
\(n_{HCl}=2x=2.0,2=0,4\left(mol\right)\\ \Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\\ \Rightarrow m_{ddHCl}=\dfrac{14,6.100}{36,5}=40\left(g\right)\\ \Rightarrow V_{ddHCl}=\dfrac{m_{ddHCl}}{D_{ddHCl}}=\dfrac{40}{1,25}=32\left(ml\right)=0,032\left(l\right)\)

Do Cu ko tác dụng HCl nên chỉ có Fe td
n(FeCl2)=0.2 mol
Fe + 2HCl => FeCl2 + H2
0,2 0,2
2Fe + 3Cl2 => 2 FeCl3
0,2 0,2
=> m(FeCl3)=0,2*162.5=32.5 g
Cu + Cl2 => CuCl2
=> m( CuCl2)=59,5-32,5=27g=> n(CuCl2)=0.2 mol
=> mCuCl2=0.2*135=27g => %= 27/59.5=45.4%
b) nHCl=2nFe=0.4 mol=> mHCl=0.4*36.5=14.6g
=> mdd=14.6/0.1=146=> V=146ml
Do Cu ko tác dụng nên chỉ có Fe td
n FeCl2 = 0,2 mol
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,2...................0,2
2Fe + 3Cl2 \(\rightarrow\) 2FeCl3
0,2....................0,2
m FeCl3 = 0,2 . 162,5 = 32,5g
Cu + Cl2 \(\rightarrow\) CuCl2
m CuCl2 = 59,5 - 32,5 = 27 g
n CuCl2 = 0,2 mol
m CuCl2 = 0,2 . 135 = 27 g
%m CuCl2 = 27 : 59,5 . 100% = 45,4 %
b, n HCl = 2n Fe = 0,4 mol
m HCl = 0,4 . 36,5 = 14,6 g
m dd HCl = 14,6 : 0,1 = 146
\(\Rightarrow\) V = 146 ml

hoa tan hoan toan 5,6 g fe bang dd luu huynh dioxit loan .the tich khi duy nhat thu duoc la :(fe=56)
thoi hoi tho vao nuoc voi trong .hien tuong say ra la

Đáp án D
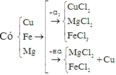
Theo định luật bảo toàn khối lượng ta có:
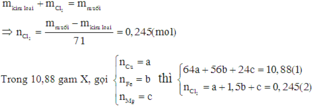
Khi cho (a + b + c) mol X tác dụng với dung dịch HCl dư thì thu được (b + c) mol H2.
Khi cho 0,44 mol X tác dụng với dung dịch HCl dư thì thu được 0,24 mol H2.
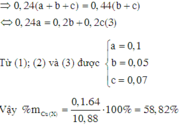

\(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\\n_{Fe}=c\left(mol\right)\end{matrix}\right.\)⇒ 24a + 27b + 56c = 26,05(1)
\(Mg + 2HCl \to MgCl_2 + H_2\\ 2Al +6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = a + 1,5b + c = \dfrac{13,44}{22,4} = 0,6(2)\)
\(Mg + Cl_2 \xrightarrow{t^o} MgCl_2\\ 2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Cl_2} = a + 1,5b + 1,5c = \dfrac{17,36}{22,4} = 0,775(3)\)
Từ (1)(2)(3) suy ra: a = 0,325 ; b = -0,05 ; c = 0,35
→ Sai đề.

Đáp án B
Trong 10,88g X gọi số mol Cu, Fe và Mg là x, y, z
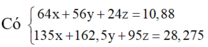
Trong 0,44 mol X có kx mol Cu, ky mol Fe và kz mol Mg (giữ đúng tỉ lệ)
Do đó kx + ky + kz = 0,44 (1)
Khi cho X tác dụng với HC1 thì
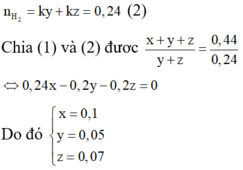
Vậy phần trăm khối lượng của Cu trong X là 58,82%
2Fe + 3 Cl 2 → t ° 2Fe Cl 3 ( M FeCl 3 = 162,5 gam)
Cu + Cl 2 → t ° Cu Cl 2
Fe + 2HCl → Fe Cl 2 + H 2 ( M FeCl 2 = 127 gam)
n Fe = x mol
Theo đề bài và phương trình hóa học trên ta có:
127x = 25,4 => 0,2 mol
162,5x + 135y = 59,5. Thay x = 0,2 vào phương trình, ta có:
32,5 + 135y = 59,5 => y = 0,2
m FeCl 3 = 0,2 x 162,5 = 32,5g
m CuCl 2 = 0,2 x 135 = 27g
% m FeCl 3 = 32,5 : (32,5 + 27).100% = 54,62%
% m CuCl 2 = 100% - 54,62% = 45,38%