Trong tự nhiên oxi có 3 đồng vị O 16 (x1%), O 17 (x2%), O 18 (4%), nguyên tử khối trung bình của oxi là 16,14. Phần trăm đồng vị O 16 và O 17 lần lượt là:
A. 35% và 61%
B. 90% và 6%
C. 80% và 16%
D. 25% và 71%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có :
x1 + x2 + 4 = 100
A ¯ = 16 x 1 + 17 x 2 + 18 . 4 100 = 16 , 14
Vậy x1 = 90, x2 = 6

Đáp án B
Luôn có x1 + x2 + 4 = 100 (1)
Nguyên tử khối trung bình của O là
16 , 4 = ( 16 x 1 + 17 x 2 + 18 . 4 ) / 100 (2)
Từ (1) và (2) => x 1 = 90 ; x 2 = 6

\(\%^{35}Cl=x\%\Rightarrow\%^{37}Cl=\left(100-x\right)\%\)
\(\overline{M}=\dfrac{35x+37\cdot\left(100\%-x\right)}{100\%}=35.5\left(g\text{/}mol\right)\)
\(\Rightarrow x=75\%\)
\(\%^{37}Cl_{\left(HClO_4\right)}=\dfrac{25\%\cdot37}{1+35.5+16\cdot4}\cdot100\%=9.2\%\)
Phần trăm đồng vị 35Cl = x, thì % đồng vị 37Cl = 100 - x
Ta có:
, vậy x = 75%.
Phần trăm khối lượng của 37Cl trong HClO4=
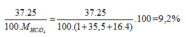

\(a.\overline{NTK}_B=\dfrac{10.18,89\%+11.81,11\%}{100\%}=10,8111\left(đ.v.C\right)\\ b.\overline{NTK}_O=\dfrac{16.99,757\%+17.0,039\%+18.0,204\%}{100\%}=16,00447\left(đ.v.C\right)\)

HD:
Số nguyên tử của 16O là 99,757/0,039 = 2558 nguyên tử, số nguyên tử 18O là 0,204/0,039 = 5 nguyên tử
Đáp án B
Theo giả thiết đề bài ta có hệ:
x 1 + x 2 + 4 = 100 ( V ì O c h ỉ c ó 3 đ ồ n g v ị ) M = 16 x 1 + 17 x 2 + 18 , 4 100 = 16 , 14 ⇔ x 1 = 90 x 2 = 6