Trong tự nhiên kali có hai đồng vị K 19 39 và K 19 41 . Tính thành phần phần trăm về khối lượng của K 19 39 có trong KClO4.
A. 63%
B. 93,5%
C. 26,3%
D. 1,82%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ChọnC
Nguyên tử khối trung bình của Cl là :
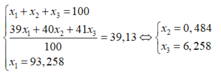
Giả sử có 1 mol K C l O 4 → Số mol Cl = 1; số mol C 35 l là 0,75.
Phần trăm khối lượng của C 35 l trong K C l O 4 là
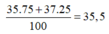

Gọi x là phần trăm số mol của 39K
Ta có: \(\dfrac{39x+41\left(100-x\right)}{100}=39,13\)
\(\Rightarrow x=99,98\%\)
Gỉa sử \(n_{KCl}=1\left(mol\right)\)
\(\Rightarrow n_K=1\left(mol\right)\)
\(\Rightarrow n_{^{39}K}=0,9998\left(mol\right)\)
\(\Rightarrow\%m^{39}K=\dfrac{0,9998.39.100}{39,13+35,5}=52,25\%\)
Gọi X là phần trăm của 39K
Ta có : \(39.13=\dfrac{39X+41\left(100-X\right)}{100}\)
=> X=93.5%
% KL 39K là : \(\dfrac{39.93,5\%}{35.5+39.13}\cdot100=48,86\%\)

Giả sử: %35Cl trong tự nhiên là a.
⇒ %37Cl trong tự nhiên là 100 - a
Ta có: \(\dfrac{35.a+37.\left(100-a\right)}{100}=35,5\Rightarrow a=75\%=\%^{35}Cl\)
⇒ %37Cl = 25%
Mà: %37Cl trong KClOx là 6,678%
\(\Rightarrow\dfrac{25\%.37}{25\%.37+75\%.35+39+16x}=0,6678\)
\(\Rightarrow x=4\)

\(\overline{M}=\dfrac{39\cdot93.3\%+41\cdot6.7\%}{100\%}=39.134\left(\dfrac{g}{mol}\right)\)
Đáp án C.
Gọi phần trăm về số nguyên tử đồng vị (phần trăm về số mol) của 3919K và 4119K là x1 và x2 ta có:
x 1 + x 2 = 100 39 x 1 + 41 x 2 100 = 39 , 13 ⇒ x 1 = 93 , 5 x 2 = 6 , 5
Giả sử có 1 mol KClO4 thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol 3919K là 1.0,935 =0,935 mol.
Vậy thành phần phần trăm về khối lượng của 3919K có trong KClO4 là:
% K 19 39 = 0 , 935 . 39 39 , 13 + 35 , 5 + 16 . 4 . 100 = 26 , 3 %