Cho 26, 8 g hỗn hợp bột X gồm Al và Fe2 O3 Tiến hành phản ứng nhiệt nhôm cho đến khi hoàn toàn hỗn hợp sau phản ứng cho tác dụng với dung dịch HCl được 12, 2 lít H2 ở điều kiện tiêu chuẩn Khối lượng của Al trong x là bao nhiêu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow n_{Al}=\dfrac{3}{2}n_{H_2}=\dfrac{3}{2}\cdot0,5=0,75mol\)
\(\Rightarrow m_{Al}=0,75\cdot27=20,25\left(g\right)\)

1) Cho 26,8 gam hỗn hợp bột X gồm : Al và Fe2O3, tiến hành phản ứng nhiệt nhôm cho tới khi hoàn toàn ( giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe ). Hỗn hợp sản phẩm sau phản ứng cho tác dụng với lượng dư dd HCl được 11,2 lít H2 (dktc). Khối lượng của Al trong X là bao nhiêu.
Trường hợp 1: Giả sử Al, Fe2O3 đều phản ứng hết.
2Al + Fe2O3 ---> Al2O3 + 2Fe (1)
==> Vậy hỗn hợp sau pứ gồm Al2O3 và Fe cho td với HCl thì chỉ có Fe tạo khí.
==> nFe=nH2=0,5mol (Thế nFe lên PT (1) thì thấy khối lượng Al và Fe2O3 lên tới 53,5g>26,8g ban đầu)
==> TRƯỜNG HỢP NÀY SAI
_______________________________________...
Trường hợp 2: Al dư và Fe2O3 hết
2Al + Fe2O3 ---> Al2O3 + 2Fe (1)
Nếu Al dư thì hỗn hợp sau pứ sẽ có thêm Al. Vậy hh sau pứ gồm (Al dư, Al2O3, Fe)
Cho hh trên tác dụng với HCl thì chỉ có Al, và Fe tạo khí H2.
Gọi nAl ban đầu là a, nAl pứ là x -->nAl dư=(a-x) , nFe2O3=x/2 và nFe=x
-Al td với HCl tạo ra 1,5mol khí H2. Vậy nH2=1,5(a-x)
-Fe td với HCl tạo ra 1mol khí. Vậy nH2=x
==> Tổng nH2=1,5(a-x) + x =0,5 mol
Viết lại:
1,5(a-x) + x =0,5 mol
27a + 80x =26,8 (Và 1 phương trình theo khối lượng ban đầu)
==> a=0,4mol, x=0,2mol
Vậy nAl=0,4mol
=> mAl=10,8g

Đáp án A
Hỗn hợp rắn gồm Al, Al2O3, Fe với n Fe = 2 n Al 2 O 3 . Chia thành 2 phần không bằng nhau:
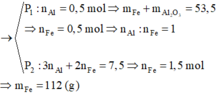

\(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
Gọi số mol Al, Fe là a, b
=> 27a + 56b = 2,78
2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b--------------->b----->b
=> 1,5a + b = 0,07
=> a = 0,02; b = 0,04
=> mFeCl2 = 0,04.127 = 5,08 (g)
=> C

Đáp án D
2 Al + Fe 2 O 3 → t o Al 2 O 3 + 2 Fe
Hỗn hợp sau phản ứng gồm A12O3, Fe, Al và Fe2O3.
Khi cho hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 tan, chất rắn còn lại gồm Fe và Fe2O3

Giả sử Al dư sau phản ứng :
Gọi $n_{Al} = a(mol) ; n_{Fe_2O_3} = b(mol)$
$\Rightarrow 27a + 160b = 26,8(1)$
\(2Al+Fe_2O_3\xrightarrow[]{t^o}2Fe+Al_2O_3\)
2b b 2b (mol)
$n_{Al\ dư} = a - 2b(mol)$
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = (a - 2b).\dfrac{3}{2} + 2b = \dfrac{12,2}{22,4} (2)$
Từ (1)(2) suy ra a = 0,43 ; b = 0,096
$m_{Al} = 0,43.27 = 11,61(gam)$
ban ơi mình ghi sai đề mất rồi phải là 11,2l khí mới đúng ạ