Điều chế NH3 từ hỗn hợp gồm N2 và H (tỉ lệ mol 1:3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,6. Hiệu suất phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A

Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9.
→Khối lượng mol của hỗn hợp khí sau phản ứng là 8,5 : 0,9=85/9 (g/mol)


Đáp án D
+ B ả n c h ấ t p h ả n ứ n g : N 2 ( k h í ) + 3 H 2 ( k h í ) ⇆ p, xt, t o 2 N H 3 ( k h í ) ⇒ S a u p h ả n ứ n g n k h í g i ả m = 0 , 5 n k h í t h a m g i a s a u p h ả n ứ n g . + C h ọ n n H 2 = 3 ; n N 2 = 1 n H 2 p ư = 3 x ; n N 2 p ư = x ⇒ n 1 = n t p ¨ o = 4 n 2 = n s p ư = n 1 + n k h í g i ả m = 4 - 2 x + B T K L : m 1 = m 2 ⇒ n 1 M ¯ 1 = n 2 M ¯ 2 ⇒ n 2 n 1 = M ¯ 1 M ¯ 2 ⇒ 4 - 2 x 4 = 0 , 9 ⇒ x = 0 , 2 . ⇒ H = 20 %

Chọn D
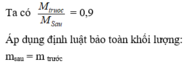
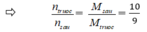
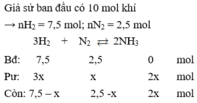
(Do ban đầu số mol N2 : H2 = 1 : 3 → hiệu suất tính theo H2 hoặc N2)
Sau phản ứng n = nH2 + nN2 + nNH3 = 7,5 - 3x + 2,5 – x + 2x = 10 – 2x = 9
→ x = 0,5 ⇒ H% = (0,5/2,5). 100% = 20%

Gọi N2 ban đầu là a thì H2 ban đầu là 3a,
gọi số mol N2 p/ứ là b:.
\(N_2+3H_2\rightarrow2NH_3\)
\(b\) \(3b\) \(2b\)
Ta có :
\(\frac{2b+\left(a-b\right)+\left(3a-3b\right)}{a}=0,6\)
Từ đó : \(\Rightarrow\frac{b}{a}=0,8\) hay \(H=80\%\)
Gọi số mol N2 ban đầu là x
số mol H2 ban đầu là 3x
số mol N2 phản ứng là a
Ta có PT:
N2 + 3H2 ⇌ 2NH3
Số mol hh B \(\left\{{}\begin{matrix}N_2:x-a\left(mol\right)\\H_2:3x-3a\left(mol\right)\\NH_3:2a\left(mol\right)\end{matrix}\right.\)
Ta có: \(\overline{M}_A\)=\(\frac{m_A}{n_A}\); \(\overline{M}_B\)= \(\frac{m_B}{n_B}\)
và mA = mB
=> dA/B = \(\frac{\overline{M}_A}{\overline{M_B}}\)=\(\frac{n_A}{n_B}\)=0,6
Mà nA = x + 3x = 4x, nB = 4x - 2a
=> \(\frac{4x-2a}{4a}=0,6\)=> a = 0,8x
H = \(\frac{a}{x}.100\%=80\%\)