Thực hiện phản ứng giữa N2 và H2 (tỉ lệ mol 1:4) trng bình kín có xúc tác thu được hỗn hợp có áp suất giảm 20% so với ban đầu ( cùng điều kiện). Hiệu suất phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn B
nH2 = 4 mol; nN2 = 1 mol
Hỗn hợp khí có áp suất giảm 9%
→ Số mol sau phản ứng = 91%.5 = 4,55 mol
3H2 + N2 ⇆ 2NH3 do số mol H2 : N2 = 4 : 1 nên hiệu suất tính theo N2
Pư: 3x x 2x
n hỗn hợp sau pư = n H2 dư + n N2 dư + n NH3 = 4 -3x + 1 – x + 2x = 5 -2x = 4,55
ð x = 0,225 => H% = 22,5%

Đáp án C
Giả sử có 1 mol hỗn hợp đầu. Gọi x và y (mol) lần lượt là số mol của N₂ và H₂ trong 1 mol hỗn hợp đầu
Gọi n₁, P₁ và n₂, P₂ lần lượt là số mol hỗn hợp khí + áp suất trong bình ban đầu và lúc sau
⇒ n₁ = x + y = 1 (1)
Khi nhiệt độ không đổi
⇒ n₁ / n₂ = P₁ / P₂
Áp suất khí trong bình giảm 5% so với áp suất ban đầu ⇒ P₁ / P₂ = 20 / 19
⇒ n₁ / n₂ = 20 / 19 (2)
Số mol của nito đã phản ứng là 10% ⇒ N₂ pứ 0,1x mol
N₂ + 3H₂ → 2NH₃
Trước: x y 0
Pứ 0,1x 0,3x 0,2x
Sau: n N₂ = 0,9x ; n H₂ = y - 0,3x ; n NH₃ = 0,2x
⇒ n₂ = 0,9x + y - 0,3x + 0,2x
⇒ n₂ = 0,8x + y (3)
Từ (1) (2) & (3) ta có:
(x + y) / (0,8x + y) = 20 / 19
⇒ 3x - y = 0 (4)
Giải hệ (1) & (4) cho ta: x = 0,25 mol và y = 0,75 mol
Thành phần phần trăm về số mol của N₂ và H₂ trong hỗn hợp đầu là:
%N₂ = 25% và %H₂ = 75%


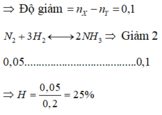

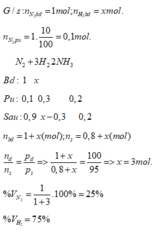
 A.
A.