Cho một mẩu hỗn hợp kim Na-Ba tác dụng với nước (dư ) , thu được dung dịch X và 3,36 lít khí H2( dktc ). Thể tích dung dịch axit H2SO4 2M cần dùng để trung hòa dung dịch X là ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Na + H2O → NaOH + H2 (1)
Ba + 2H2O → Ba(OH)2 + H2 (2)
Theo (1) và (2) n OH - ( dd X ) = 2 n H 2 = 0 , 3 mol
Phương trình ion rút gọn của dung dịch axit với dung dịch bazơ là
H+ + OH- → H2O
⇒ n H + = n OH - = 0 , 3 mol → n H 2 SO 4 = 0 , 15 mol
⇒ V H 2 SO 4 = 0 , 15 2 = 0 , 075 lit
=> Đáp án B

2Na + 2 H 2 O → 2NaOH + H 2
Ba + 2 H 2 O → B a O H 2 + H 2
Từ 2 phương trình trên ta có nhận xét:
n O H - = 2 n H 2 = 2.33,6/22,4 = 0,15 mol
Mà: O H - + H + → H 2 O
⇒ n O H - = n H + = 0,15 mol = nHCl
⇒ V H C l = 0,15/2 = 0,075 lit = 75ml
⇒ Chọn B.
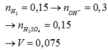
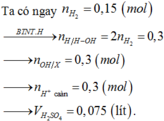
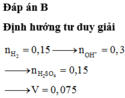
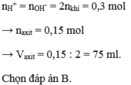
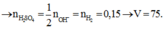
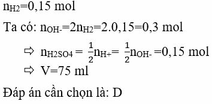
Ta có: \(n_{H_2}=0,15\left(mol\right)\)
Mà: \(n_{OH^-}=2n_{H_2}=0,3\left(mol\right)\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
______0,3 ← 0,3 __________ (mol)
BTNT H, có: \(n_{H_2SO_4}=\frac{1}{2}n_{H^+}=0,15\left(mol\right)\)
\(\Rightarrow V_{H_2SO_4}=\frac{0,15}{2}=0,075\left(l\right)\)
Bạn tham khảo nhé!
bạn chăm thế !!!!!!!