Tại sao bài toán sục Khí SO2 vào dung dịch kiềm như NAOH lại tạo ra muối trung hoà NA2SO3 trước nếu So2 dư thì mới đến NAHsO3 ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có nếu SO2 phản ứng hết thì có PT:
PTHH: SO2 + 2NaOH -> Na2SO3 + H2O
Nhưng nếu SO2 dư sẽ có phản ứng sau:
SO2 + Na2SO3 + H2O -> 2NaHSO3
Giải thích cho cơ sở này như sau:
Khi lên cấp 3, khi học về ion ta sẽ thấy:
Muối Na2SO3 sẽ được cấu tạo từ ion Na+ và ion SO3-
Lại có: Bazơ NaOH là 1 bazơ mạnh => ion Na+ có tính của bazơ mạnh
Axit H2SO3 là 1 axit rất yếu => ion SO3- có tính của axit yếu
=> Muối Na2SO3 có tính bazơ
Hỗn hợp SO2 + H2O chính là H2SO3 bị phân hủy thành nên hỗn hợp SO2 + H2O mang tính axit
axit luôn có thể tác dụng với bazơ nên có xảy ra phản ứng
SO2 + H2O + Na2SO3 -> 2NaHSO3

Đáp án D
SO2 + 2H2S → 3S + 2H2O
2F2 + 2H2O → 4HF + O2
2KMnO4 + 16HCl đặc → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
CO2 + 2NaOH → Na2CO3 + H2O
Si + 2NaOH + H2O
→
Na2SiO3 + 2H2
Na2SO3 + H2SO4
→
Na2SO4 + SO2 + H2O
=> Các phản ứng a, b, c, e tạo ra đơn chất

SO2 + 2H2S ![]() 3S + 2H2O
3S + 2H2O
2F2 + 2H2O ![]() 4HF + O2
4HF + O2
2KMnO4 + 16HCl đặc ![]() 2KCl + 2MnCl2 + 5Cl2 + 8H2O
2KCl + 2MnCl2 + 5Cl2 + 8H2O
CO2 + 2NaOH ![]() Na2CO3 + H2O
Na2CO3 + H2O
Si + 2NaOH + H2O ![]() Na2SiO3 + 2H2
Na2SiO3 + 2H2
Na2SO3 + H2SO4 ![]() Na2SO4 + SO2 + H2O
Na2SO4 + SO2 + H2O
Các phản ứng a, b, c, e tạo ra đơn chất
Chọn D.

\(n_{NaHSO_3}=\dfrac{10,4}{104}=0,1\left(mol\right)\\ n_{Na_2SO_3}=\dfrac{12,6}{126}=0,1\left(mol\right)\)
PTHH:
\(NaOH+SO_2\rightarrow NaHSO_3\)
0,1 0,1 0,1
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
0,2 0,1 0,1
\(\rightarrow\left\{{}\begin{matrix}V=\left(0,1+0,1\right).22,4=4,48\left(l\right)\\C_{MNaOH}=\dfrac{0,1+0,2}{0,4}=0,75M\end{matrix}\right.\)

Đáp án B
Đơn chất là chất được tạo nên từ một nguyên tố. Thí dụ: Na,O2,N2,Cl2,O3 là các đơn chất.
Hợp chất là các chất được tạo nên từ hai nguyên tố trở lên. Thí dụ: NaCl,H2SO4,…
( a ) SO 2 + 2 H 2 S → 3 S ↓ + 2 H 2 O ( b ) 2 F 2 + 2 H 2 O → 4 HF + O 2 ↑ ( c ) 2 KMnO 4 + 16 HCl → 2 MnCl 2 + 5 Cl 2 ↑ + 2 KCl + 9 H 2 O ( d ) CO 2 + NaOH → NaHCO 3 CO 2 + 2 NaOH → Na 2 CO 3 + H 2 O ( e ) Si + 2 NaOH + H 2 O → Na 2 SiO 3 + 2 H 2 ↑ ( g ) Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + SO 2 ↑ + H 2 O
Các thí nghiệm sinh ra đơn chất là (a),(b),(c),(e)

Chọn đáp án D
Các phản ứng hóa học sinh ra chất khí:
SO2 + H2S → 3S↓ +2H2O
2F2 + H2O → 4HF + O2
2KMnO4 +16HCl → 2KCl + 2MnCl2 +5Cl2 +8H2O
Si + 2NaOH + H2O → Na2SiO3 + H2

Đơn chất là chất được tạo nên từ một nguyên tố. Thí dụ: Na,O2,N2,Cl2,O3 là các đơn chất
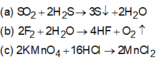
![]()
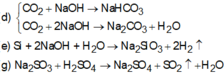
Các thí nghiệm sinh ra đơn chất là (a), (b), (c), (e).
Đáp án B

Chọn D.
Các phản ứng tạo ra đơn chất là (a), (b), (c), (e).
Vì có phản ứng NaOH + NaHSO3 → Na2SO3 + H2O
nếu NaOH chưa hết thì luôn sinh ra Na2SO3 nên luôn tạo muối trung hòa trước.
Khi SO2 dư thì xảy ra pứ Na2SO3 + SO2 + H2O → 2NaHSO3 tạo muối axit.
Trong bài toán sục khí SO2 vào dd kiềm thì tính axit trong dung dịch sẽ tăng dần theo thời gian và chỉ khi nào trong dung dịch , tính axit nhiều hơn tính bazo thì nó mới tạo muối axit . Ban đầu thì lượng axit được sục vào là chưa đáng kể nên tính bazo sẽ lấn át tính axit , do đó chỉ tạo toàn muối trung hoà . Muối trung hoà sẽ tiếp tục được tạo ra cho tới khi bazo = axit thì lúc đó , 100% dung dịch chỉ bao gồm muối trung hoà . Nhưng ta lại tiếp tục sục thêm SO2 vào , làm tăng tính axit cho dung dịch muối . Lúc này , tính axit bắt đầu chiếm ưu thế trong dung dịch , kết quả là tạo ra muối axit .
P/s : Nói nôm na là vậy á , mình đã cố gắng giải thích dễ hiểu nhất có thể rồi đó ạ :v