Nung hỗn hợp gồm FeS và FeS2 trong một bình kín chứa không khí (oxi chiếm 20%, nitơ chiếm 80% thể tích) đến khi các phản ứng xảy ra hoàn toàn thu được một chất rắn duy nhất và hỗn hợp Y có thành phần thể tích 84,8% N2, 14,0% SO2 còn lại là O2. Xác định phần trăm khối lượng FeS có trong X
Các cao nhân giúp em vs ạ

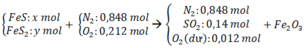
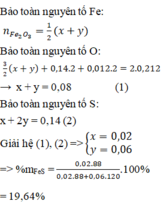
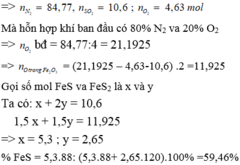
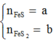
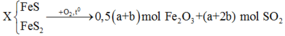

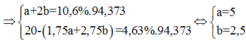
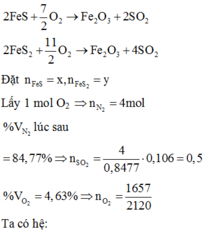
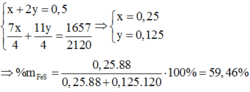
Chọn 1 mol hỗn hợp Y =>số mol N2 = 0,848 mol; số mol O2 ban đầu = 0,212 mol
=>số mol O2 phản ứng = 0,212 – 0,012 = 0,2 mol
2FeS + 3,5O2 → Fe2O3 + 2SO2
a→ 1,75a→ a
2FeS2 + 5,5O2 → Fe2O3 + 4SO2
b → 2,75b → 2b
=>1,75a+2,75b = 0,2
a+2b= 0,14
=>a=0,02; b=0,06
%khối lượng FeS = 0,02.88\0,02.88+0,06.120.100% = 19,64%
em cảm ơn