49. Cho m gam KMNO4 tác dụng với dd HCl đặc ,dư thu đc dd X có chứa 28,07g 2 muối và V lít khí Cl2(đktc). Lượng khí Cl2 sinh ra tác dụng vừa đủ vs 7,5g hỗn hợp kim loại Al và M( có tỉ lệ mol tương ứng là 1:2). Kim loại M là?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phân số bị lỗi mk chữa lại nha, cái đầu tiên là \(\frac{2,775}{0,175.2}\)
cái thứ hai là \(\frac{4,8}{0,1.2}\)
Học tốt nha ![]()

Bài 15. Lời giải:
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 8H2O + 5Cl2
Theo PTHH : \(n_{KCl}=n_{MnCl_2}=x\)
Khối lượng muối = 28,07 ⇒ \(m_{KCl}+m_{MnCl_2}=28,7\)
⇒ x . 74,5 + x . 126 = 28,07
⇒ x = 0,14 mol
\(\Rightarrow n_{KCl}=n_{MnCl_2}=0,14mol\)
Theo PTHH ⇒ \(n_{Cl_2}=\frac{5}{2}n_{KCl}=\frac{5}{2}.0,14=0,35mol\)
Theo định luật bảo toàn e : \(x.n_M+3n_{Al}=2n_{Cl_2}=0,7mol\)
Có tỉ lệ mol Al : M = 1 : 2 \(\Rightarrow\) nAl = a thì nM = 2a
⇒ 2a.x + a.3 = 0,7 mol
Với x = 1 ⇒ a = 0,175 mol ⇒ m Al = 0,175.27 = 4,725 gam
⇒ mM = 7,5 – 4,725 = 2,775 gam
⇒ \(M_M=\frac{2,775}{0,175.2}=7,9\)(loại)
Với x = 2 ⇒ a = 0,1 mol ⇒ mAl = 27.0,1 = 2,7 gam ⇒ m M = 7,5 – 2,7 = 4,8 gam
\(\Rightarrow M_M=\frac{4,8}{0,1.2}=24\)(Mg, chọn)
Vậy kim loại cần tìm là Mg
Bài 14. Lời giải:
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\\ n_{Cl_2}=\frac{2,5-1,61}{44,5}=0,02\left(mol\right)\\ C\%_{Cl_2}=\frac{0,02.71}{25}.100\%=5,68\%\)

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
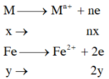
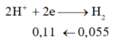
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
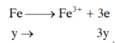
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C

Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn

- Theo bài ra \(\Rightarrow\left\{{}\begin{matrix}n_{KMnO_4}=0,1\\n_{KClO_3}=0,15\end{matrix}\right.\) ( mol )
\(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
.......0,1..........................................................0,25...........
\(KClO_3+6HCl\rightarrow KCl+3Cl_2+3H_2O\)
....0,15................................0,45....................
\(\Rightarrow n_{HCl}=0,7\left(mol\right)\)
\(6KOH+3Cl_2\rightarrow KClO_3+5KCl+3H_2O\)
Ta có : \(m=m_{KOH}+m_{Cl_2}=139,3\left(g\right)\)
Vậy ...






\(KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2+8H_2O\)
Gọi a là mol Cl2 sinh ra
\(n_{KCl}=n_{MnCl2}=2,5a\left(mol\right)\)
\(\Rightarrow74,5.2,5a+126.2,5a=28,07\)
\(\Rightarrow a=0,056\)
Gọi a, 2a là mol Al, M
\(2Al+3Cl_2\rightarrow2AlCl_3\)
\(2M+nCl_2\rightarrow2MCl_n\)
\(\Rightarrow1,5a+na=0,056\)
\(\Rightarrow a=\frac{0,056}{1,5+n}\left(1\right)\)
\(27a+M.2a=7,5\)
\(\Rightarrow a=\frac{7,5}{27+2M}\left(2\right)\)
\(\left(1\right)+\left(2\right)\Rightarrow\frac{0,056}{1,5+n}=\frac{7,5}{27+2M}\)
\(\Rightarrow7,5\left(1,5+n\right)=0,056.\left(27+2M\right)\)
Không có n thoả mãn M