Bài 1: Cho một lượng bột sắt dư tác dụng với dung dịch H2SO4 đặc nóng, thu được 20g Fe2(SO4)3 theo pt. Fe+H2SO3 đặc nóng ---> Fe2(SO4)3+SO2+H2O
A) hoàn thành phương trình tính khối lượng bột sắt và khối lượng H2SO4 đã tham gia phản ứng
B) tính thể tích SO2 sinh ra ở điều kiện tiêu chuẩn
Bài 2 :
Cho hỗn hợp gồm Ag và Al tác dụng với dung dịch H2SO4 dư tạo ra 6,72 lít khí H2 thoát ra ở điều kiện tiêu chuẩn và 5,4 gam chất rắn không tan tính % về khối lượng của từng kim loại trong hỗn hợp? ( biết rằng eg không tác dụng với H2 SO4)


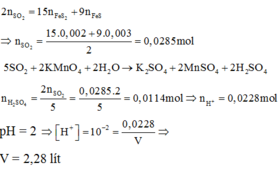
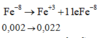
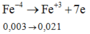
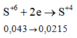

a)\(2Fe+6H2SO4-->Fe2\left(SO4\right)3+3SO2+6H2O\)
\(n_{Fe2\left(SO4\right)3}=\frac{20}{400}=0,05\left(mol\right)\)
\(n_{Fe}=2n_{Fe2\left(SO4\right)3}=0,1\left(mol\right)\)
\(m_{Fe}=0,1.56=5,6\left(g\right)\)
\(n_{H2SO4}=6n_{Fe2\left(SO4\right)3}=0,3\left(mol\right)\)
\(m_{H2SO4}=0,3.98=29,4\left(g\right)\)
b)\(n_{SO2}=3n_{Fe2\left(SO4\right)3}=0,15\left(mol\right)\)
\(V_{SO2}=0,15.22,4=3,36\left(l\right)\)
Bài 2
\(2Al+H2SO4-->Al2\left(SO4\right)3+3H2\)
\(n_{H2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{Al}=\frac{2}{3}n_{H2}=0,2\left(mol\right)\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
m chất rắn là \(m_{Ag}=5,4\left(g\right)\)
\(\%m_{Ag}=\frac{5,4}{5,4+5,4}.100\%=50\%\)
\(\%m_{Al}=100-50=50\%\)