1. Nung a gam KClO3 và b gam KMnO4 cùng đc thể tích O2 bằng nhau. Tính tỉ lệ a:b. 2. Đốt cháy hoàn toàn 5,6 lít hh gồm 2 chất khí CnH2n+2 và CxH2n có thể tích lần lượt là V1, V2 thu đc 11,2 lít CO2 và 10,8g hơi nước. Tính V1 và V2(đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Từ mKCl = 0,894g => mY = 10,994g
Đặt nO2 tạo ra = x => nkk = 3x có nO2 = 0,75x và nN2 = 2,25x (mol)
, nCO2 = nC = 0,044 mol => nO2 dư = (x + 0,75x) – 0,044 (mol)
=> nT = nCO2.100/22,92 = nO2 dư + nN2 + nCO2
=> 1,75x – 0,044 + 2,25x + 0,044 = 0,192
=> x = 0,048 mol
=> m = mY + mO2 tạo ra = 12,53g
=>B

Đáp án : A
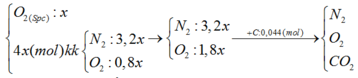
C + O2 à CO2 ( số mol khí trước và sau phản ứng không đổi)
=> nCO2 = nC = 0,044 = 5x.22% => x = 0,04 mol
m = mY + mO2 = mKCl. 100 19 , 893 + 32.0,04 = 8,77g

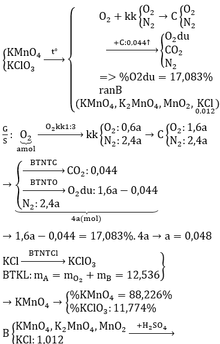
Gọi a , b là số mol của KClO3 và KMnO4
TH1: Y có CO2 , N2 , O2 dư
2KClO3 ➝ 2KCl + 3O2
2KMnO4 ➝ K2MnO4 + MnO2 + O2
Gọi nO2 = x => \(\dfrac{nO_{2_{ }}}{_{ }kk}\) = 3x . 0,2 = 0,6x
nN2 = 3x.0,8 = 2,4x
C + O2 ➝ CO2
nCO2 = nC = \(\dfrac{0,528}{12}\) = 0,044
hh khí gồm : nCO2 = 0,044 ; nO2 = 1,6x - 0,044 ; nN2 = 2,4x
=> 0,044 + 1,6x - 0,044 + 2,4x = \(\dfrac{0,044.100}{22,92}\)
<=> x = 0,048
=> mhh đầu = mY + mO2 = \(\dfrac{0,894.100}{8,132}\) + 0,048.32 = 12,53
TH 2 : Y có CO , CO2 ; N2
Bảo toàn C : nCO + nCO2 = nC = 0,044 => nCO = 0,044 - nCO2
Bảo toàn O : 0,5.nCO + nCO2 = nO2 = 1,6a
⇒ 0,5.( 0,044 - nCO2 ) + nCO2 = 1,6a => nCO2 = 3,2a - 0,044
Tổng mol hh : nCO + nCO2 + nN2 = 0,044 + 2,4a
=> \(\dfrac{3,2a-0,044}{0,044+2,4a}\) = \(\dfrac{22,92}{100}\)
a ≈0.02
=> m = m rắn + mO2 = \(\dfrac{0,894.100}{8,132}\) + 0,02 . 32 = 11,646 ( g )

$\%m_{O_2(X)}=\dfrac{1,6}{1,6+4,4}.100\%=26,67\%$
$n_{CO_2}=\dfrac{4,4}{44}=0,1(mol);n_{O_2}=\dfrac{1,6}{16}=0,05(mol)$
$\Rightarrow \%V_{O_2(X)}=\dfrac{0,05}{0,05+0,1}.100\%=33,33\%$
$C+O_2\xrightarrow{t^o}CO_2$
Theo PT: $n_C=n_{O_2(p/ứ)}=n_{CO_2}=0,1(mol)$
$\Rightarrow n_{O_2(dùng)}=0,1+0,05=0,15(mol)$
$m_C=0,1.12=1,2(g);V_{O_2(dùng)}=0,15.22,4=3,36(lít)$
$\to m=1,2;V=3,36$


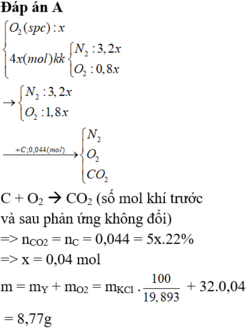
1) \(n_{KClO3}=\frac{a}{122,5}\left(mol\right)\)
\(n_{KMnO4}=\frac{b}{158}\left(mol\right)\)
\(2KClO3-->2KCl+3O2\)
\(\frac{a}{122,5}\)------------------------\(\frac{a}{40,8333}\left(mol\right)\)
\(2KMnO4-->K2MnO4+MnO2+O2\)
\(\frac{b}{158}\)-------------------------------------------------\(\frac{b}{79}\left(mol\right)\)
Thể tích O2 bằng nhau \(\Rightarrow n_{O2}\) bằng nhau
\(\Rightarrow\frac{3a}{122,5}=\frac{b}{79}\Rightarrow122,5b=237a\)
\(\Rightarrow a:b\approx1:2\)
1)
Phản ứng:
\(2KClO_3\rightarrow2KCl+3O_2\)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
Ta có :
\(n_{KClO3}=\frac{a}{39+35,5+16.3}=\frac{a}{122,5}\)
\(\Rightarrow n_{O2}=\frac{3}{2}n_{KClO3}=\frac{3a}{245}\)
Vì thể tích O2 bằng nhau nên số mol O2 tạo ra bằng nhau
\(\Rightarrow\frac{3a}{245}=\frac{3}{316}\Rightarrow a:b=\frac{1}{316}:\frac{3}{245}=0,2583\)
2)
Ta có:
\(n_{hh}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(n_{CO2}=\frac{11,2}{22,4}=0,5\left(mol\right)\)
\(n_{H2O}=\frac{10,8}{22,4}=0,6\left(mol\right)\)
Gọi số mol của CnH2n+2 là; CxH2n là b
\(a+b=0,25\)
\(\overline{C}=\frac{0,5}{0,25}=2\)
TH1: 2 chất trên đều có số C là 2, suy ra 2 chất là C2H6 a mol và CxH4 y mol.
\(n_{H2O}=3a+2b=0,6\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,15\end{matrix}\right.\)
\(\Rightarrow V_1=0,1.22,4=2,24\left(l\right)\)
\(\Rightarrow V_2=0,15.22,4=3,36\left(l\right)\)
TH2: một chất có số C là 1 Nếu n=1 suy ra chất còn lại là CxH2 không tồn tại.
Do đó nếu x=1 suy ra CxH2n phải là CH4 suy ra n=2 vậy 2 chất là C2H6 và CH4.
Mà đốt ankan \(n_{H2O}-n_{CO2}=2n_{ankan}\ne0,6-0,5\)
Loại trường hợp này