Từ 6,2 kg photpho điều chế được bao nhiêu lít dung dịch H3PO4 2M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án B
Ta có 6,2 kg = 6200 g
+ Ta có 1P → 1H3PO4.
⇒ nH3PO4 = nP × 0,8
= 6200 × 0,8 ÷ 31
= 160 mol.
⇒ VH3PO4 = 160 ÷ 2 = 80 lít

Chọn đáp án B
Ta có 6,2 kg = 6200 g
+ Ta có 1P → 1H3PO4.
⇒ nH3PO4 = nP × 0,8 = 6200 × 0,8 ÷ 31 = 160 mol.
⇒ VH3PO4 = 160 ÷ 2 = 80 lít ⇒ Chọn B

Đây là một câu dễ trong đề đại học, đề bài rất ngắn gọn nhưng cần tỉnh táo để tiết kiệm thời gian.
+ Nhận thấy lượng P ban đầu được bảo toàn thành P trong HNO3 80% vì hiệu suất cả quá trình điều chế là 80%.
+ Ta có
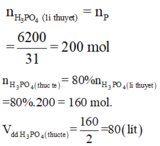
Đáp án B

Đáp án : D
Giả sử cần mg quặng => mCa3(PO4)2 = 0,95m (g)
=> Thực tế chỉ có 0,8.0,95m = 0,76m (g) Ca3(PO4)2 phản ứng
Ca3(PO4)2 -> 2H3PO4
310g 2.98g
0,76m(g) 980g
=> m = 2040g = 2,04 kg



4P+5O2----->2P2O5
P2O5+3H2O---->2H3PO4
6,2Kg=6200g
n P=\(\frac{6200}{31}=200\left(mol\right)\)
Theo pthh1
n P2O5=\(\frac{1}{2}n_P=100\left(mol\right)\)
Theo pthh2
n\(_{H3PO4}=2n_{P2O5}=200\left(mol\right)\)
V\(_{H3PO4}=\frac{200}{2}=100\left(l\right)\)