choa khí CO dư đi qua ống sứ nung nóng chứa m(g) hỗn hợp X gồm 2 oxit của 2 kim loại thu được chất rắn A và khí B.
cho toàn bộ khí B vào dung dịch nước vôi trong dư thu đc 1,5g kết tủa.
cho toàn bộ chất rắn A vào dung dịch H2SO4 10%(vừa đủ) thì thu được dung dịch muối có nồng độ 11,243% không có khí thoát ra, còn lại 0,96g chất rắn không tan. Xác định công thức của 2 oxit biết rằng các phản ứng đều xảy ra hoàn toàn.


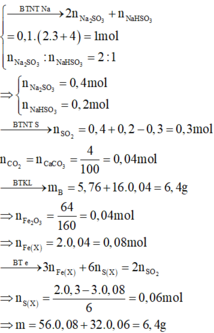


cho chất rắn A vào
đặt 2 công thức oxit là R2Oa và M2Ob
không có khí thoát ra => có 1 oxit ko bị khử ( M2Ob)
0,96 g chất rắn => R
pt hóa học
R2Oa + aCO --->(có to ở trên nha) 2R + aCO2 (1)
M2Ob + CO --x-->
vì Ca(OH)2 dư => nCO2 = n kt CaCO3 = 1,5/100 = 0,015
từ pt (1) => nR = 2.nCO2 / a = 0,03/a
mR = 0,03R/a = 0,96
với a=2 => R=64(Cu) Thỏa mãn
=> CT R2Oa là CuO
giả sử có 1 mol M2Ob tham gia phản ứng
M2Ob + bH2SO4 -> M2(SO4)b + bH2O
1 b 1 (mol)
m d d H2SO4 10% = 98b/10% = 980b (g)
md d sau phản ứng = 1(2M+16b)+980b=2M+996b
C%M2(S04)b = (2M + 96b)/(2M+996b) .100%=11,243%
(2M + 96b)/(2M+996b)=0,11243
2M + 96b =0,11243(2M+996b) = 0,22496M + 111,98028b
=> 1,77514M=15,98028b
=>M=9b
b=3=>M=27 (Al) Thỏa mãn
vậy ....
học tốt