hòa tan hoàn toàn 6,85 (g) 1 kim loại htri II R bằng 200(ml) dung dịch HCl 2M. Để trung hòa lượng axit dư cần 100ml dung dịch NaOH 3M . Xđ kim loại trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đề thiếu m
NaOH + HCl = NaCl + H2O
0,3 - - - - 0,3
=>số mol HCl pư là 0,1 mol
=>số mol OH- = số mol H+ = số mol HCl = 0,1 mol
=>số mol kiềm thổ là 0,05 mol
=>R = 6,85 / 0,05 = 137 => Ba

Đáp án A
M + H2SO4 → MSO4 + H2 (1)
2KOH + H2SO4 → K2SO4 + 2H2O (2)
![]()
Mà
![]()
![]()
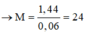
M là Magie

nHCl = 0,35 . 1 = 0,35 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,175 0,35 0,175 0,175 (mol)
nHCl (pứ 2 ) = 0,2 . 2 = 0,4 (mol)
\(X+2HCl\rightarrow XCl_2+H_2\)
0,2 0,4
\(nX=0,175+0,2=0,375\left(mol\right)\)
=> \(MX=\dfrac{11,7}{0,375}=\) 31,2 .-. k ra là s

Gọi KL là M
PTHH: M+ 2HCl----->MCl2 +H2(1)
HCl+NaOH---->NaCl +H2O(2)
Ta có
n\(_{NaOH}=0,1.3=0,3\left(mol\right)\)
Theo pthh2
n\(_{HCl}=n_{NaOH}=0,3\left(mol\right)\)
Mặt khác
n\(_{HCl}=0,2.2=0,4\left(mol\right)\)
=>n\(_{HCl}pư1=0,4-0,3=0,1\left(mol\right)\)
Theo pthh1
n\(_M=\frac{1}{2}n_{HCl}=0,05\left(mol\right)\)
M\(_M=\frac{6,85}{0,05}=137\)
=> M là Bari...Kí hiệu K

\(n_{NaOH} =0,2.0,1 = 0,02(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,01(mol)\\ \Rightarrow n_{H_2SO_4\ pư} = 0,1.0,3 - 0,01 = 0,02(mol)\)
Gọi n là hóa trị của kim loại R
\(2R + nH_2SO_4\to R_2(SO_4)_3 + nH_2\\ n_R = \dfrac{2}{n}n_{H_2SO_4} = \dfrac{0,04}{n}(mol)\\ \Rightarrow \dfrac{0,04}{n}.R = 1,3\\ \Rightarrow R = \dfrac{65}{2}n\)
Với n = 2 thì R = 65(Zn)





M+2HCl---->MCl2+H2
HCl+NaOH---->NaCl+H2O
n NaOH=0,1.3=0,3(mol)
n HCk=0,2,2=0,4(mol)
Theo pthh2
n HCl=n NaOH =0,3(mol)
---> n HCl ở Pt 1 là 0,4-0,3=0,1(mol)
Theo pthh1
n M=1/2 n HCl=0,05(mol)
M M= 6,85/0,05=137
-->M là Ba