Nung nóng một lượng muối Cu(NO3)2 . Sau một thời gian dừng lại , để nguội và đem cân thì thấy khối lượng giảm đi 54 gam .
a/ Tính khối lượng Cu(NO3)2 đã tham gia phản ứng .
b/ Tính số mol các chất khí thoát ra .
HELP ME !!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$2Cu(NO_3)_2 \xrightarrow{t^o} 2CuO + 4NO_2 + O_2$
Gọi $n_{O_2} = a \Rightarrow n_{NO_2} = 4a$
Ta có :
$32a + 46.4a = 0,54 \Rightarrow a = 0,0025(mol)$
$n_{Cu(NO_3)_2} = 2a = 0,005(mol)$
$m_{Cu(NO_3)_2} = 0,005.188 = 0,94(gam)$
Cu(NO3)2 -to-> CuO + 2 NO2 + 1/2 O2
m(giảm)= mNO2 + mO2
Đặt nO2=a (mol) -> nNO2=4a(mol)
=> 32a + 46.4a= 0,54
<=> 216a= 0,54
<=>a=0,0025(mol)
=>mCu(NO3)2= 0,005. 188=0,94(g)

| 2Cu(NO3)2 |
→ |
2CuO |
+ |
4NO2 |
+ |
O2 |
2a 2a 4a a (Gọi 2a là số mol Cu(NO3)2 bị nhiệt phân)
khối lượng giảm 0,54gam ⇒ mNO2 + mO2 = 0,54 ⇒ 4a.46 + 32a = 0,54
⇒ a = 0,0025 ⇒ m muối = 2a.188 = 0,94g
Đáp án D.

\(Cu\left(NO_3\right)_2\rightarrow CuO+2NO_2+\dfrac{1}{2}O_2\)
188 88 \(\rightarrow\) giảm 108(g)\(\Leftrightarrow1\left(mol\right)\)
giảm 54 \(\Leftrightarrow a\left(mol\right)\)
\(\Leftrightarrow108a=54\Leftrightarrow a=0,5\)
\(n_{Cu\left(NO_3\right)_2}=n_{CuO}=0,5\left(mol\right)\)
\(\rightarrow m_{Cu\left(NO_3\right)_2}=0,5.188=94\left(g\right)\)
\(n_{NO_2}=2n_{CuO}=1\left(mol\right);n_{O_2}=\dfrac{1}{2}n_{CuO}=0,25\left(mol\right)\)
\(\rightarrow V_k=22,4.\left(1+0,25\right)=28\left(l\right)\)

Đáp án C
Khối lượng giảm là tổng khối lượng của NO2 và O2:
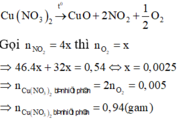
Khối lượng giảm đi là lượng khí bay lên
\(\text{Cu(NO3)2=CuO+2NO2+1/2O2}\)
Đặt mol Cu(NO3)2=x mol thì nNO2=2x, nO2=0,5x. Mà m khí=54g nên ta có pt 92x+16x=54 <=> x=0,5mol
\(\text{a, mCu(NO3)2=0,5.188=94g}\)
\(\text{b, nNO2=2.0,5=1mol; nO2=0,5.0,5=0,25mol}\)
Vậy spu thoát ra 1,25 mol khí