Đốt 0,366g một hợp chất hữu cơ A, thu được 0,792g \(\)CO2 và 0,234g H2O \(\). mặt khác phân hủy 0,549g chất đó thu được 37,42cm\(^{ }\)3 nitơ (đo ở 27 C và 750mmHg). Tìm công thức phân tử của A, biết rằng phân tử của nó chỉ chứa một nguyên tử nitơ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tham khảo:
Xét phản ứng đốt cháy 0,366 gam hợp chất A:
nCO2=0,79244=0,018mol
nH2O=0,23418=0,013mol
Bảo toàn nguyên tố C,HC,H:
nC=nCO2=0,018molnH=2nH2O=0,026mol
→ Trong 0,548 gam chất đó có:
nC=0,018⋅0,5490,366=0,027molnH=0,026⋅0,5490,366=0,039mol
Đổi:
37,42cm3=0,03742lit750mmHg=0,986842atm
Ta có:
nN2=PV/RT=0,986842.0,03742/0,082.(27+273)=1,5.10−3mol
Ta có:
mC+mH+mN=0,027.12+0,039.1+1,5.10−3.28=0,405gam→mO=0,549−0,405=0,144gam→nO=9.10−3mol
C:H:O:N=0,027:0,039:0,009:0,003=9:13:3:1
Mặt khác, phân tử A chỉ chứa một nguyên tố NN, nên công thức phân tử của A là:
C9H13NO3

Phân huỷ 0,445 gam X thu được 0,0025 mol N2O
→ Phân huỷ 0,356 gam X thu được 0,002 mol N2O
→ Số mol N trong X: 0,004 mol → mN = 0,004.14 = 0,056 gam
nCO2 = 0,012 mol → số mol C trong X: 0,012 mol → mC = 0,144 gam
nH2O = 0,014 mol → số mol H trong X : 0,028 mol → mH = 0,028 gam
mC + mH + mN = 0,228 gam < mX = 0,356 gam
→ Trong X còn có nguyên tử oxi, mO = 0,356 - 0,228 = 0,128 mol
→ Số mol O trong X : 0,008 mol
Đặt CTHH của X là CxHyOzNt
x : y : z : t = nC : nH : nO : nN = 0,012 : 0,028 : 0,008 : 0,004 = 3 : 7 : 2 : 1
Công thức phân tử đơn giản nhất của X là C3H7O2N
Vì X chỉ chứa 1 phân tử N → CTPT trùng với công thức đơn giản nhất
→ CTPT là C3H7O2N

1, Bảo toàn khối lượng: mO2 = mCO2 + mH2O – mA = 11,2 g
=> nO2 = 11,2 /32 = 0,35 mol
nCO2 = 0,3 mol, nH2O = 0,2 mol
Bảo toàn nguyên tố: nC(A) = nC(CO2) = nCO2 =0,3 mol
nH(A) = nH(H2O) = 2nH2O =0,4 mol
nO(A) = nO(H2O) + nO(CO2) – nO(O2)= 0,3.2+0,2 -0,35.2= 0,1 mol
Gọi CTPT của A là CxHyOz
=> x : y : z = nC(A) : nH(A) : nO(A) = 3 : 4 : 1
=> CT tối giản của A là C3H4O => CTPT A có dạng (C3H4O)n
MA = 14.2.2=56 => n = 1
Vậy CTPT của A là C3H4O
b/ n CO2 = 8,8 : 44 = 0,2 mol => m c = 0,2 x 12 = 2,4( g)
n H2O = 5,4 : 18 = 0,3 mol => mH = 0,3 x 2 = 0,6 (g)
Khối lượng của C và H trong A là : 2,4 + 0,6 = 3 (g)
A chỉ chứa hai nguyên tố là C và H
b/ Công thức của A là CxHy ta có:
x ; y = ( mc ; 12) : ( mH : 1) = ( 2,4 : 12) : ( 0,6 : 1) = 1 : 3
Công thức phân tử của A có dạng ( CH3) n . Vì MA =15.2
=> 15 n =30
Nếu n = 1 không đảm bảo hoá trị C
Nếu n = 2 Công thức phân tử của A là C2H6

Đáp án C
Vì đốt cháy A thu được CO2 và H2O nên A chứa C, H, có thể có O.
Khi đó gọi công thức phân tử của A là CxHyOz
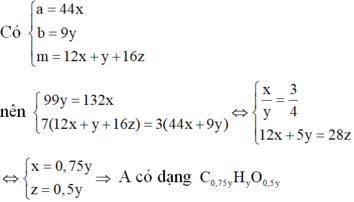
![]()
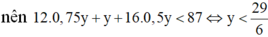
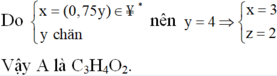
Nhận xét: Khi làm đến bước x : y = 3 :4 và kết hợp với quan sát 4 đáp án, ta có thể kết luận ngay A là C3H4O2.

a, có nCO2=11/44=0,25 mol
có nC=nCO2=0,25mol=>mC=12.0,25=3(g)
có nH2O=6,75/18=0,375mol
có nH=2nH2O=2.0,375=0,75mol=>mH=0,75(g)
=>mH+mC=0,75+3=3,75=mA
=> A gồm nguyên tố C và H
b, gọi CTPT A là CxHy
có x/y=nC/nH=0,25/0,75=1/3
=> công thức thực nghiệm (CH3)n<=>CnH3n
có MA=30 gam/mol<=>12n+3n=30<=>n=2
vậy CTPT của A là C2H6
c;PTHH: CO2+2NaOH->Na2CO3+H2O
=> nNa2CO3=nCO2=0,25mol=>mNa2CO3=0,25.106=26,5 gam

Gọi CTHH là CxHyOz
nCO2=0,4(mol)
nH2O=0,4(mol)
mC;H=0,4.12+2.0,4=5,6(g)
=>mO=12-5,6=6,4(g)
nO=0,4(mol)
=>x:y:z=0,4:0,8:0,4=1:2:1
=>CTHH tổng quát là (CH2O)x
Ta có:
\(\dfrac{12}{30x}=0,4\)
=>x=1
Vậy CTHH của HCHC là( CH2O)n
n=1 =>A =30 (l)
n=2=>A=60 nhận
n=3=>A=90 (loại )
=>CTHH: C2H4O2
\(n_{CO_2}=\dfrac{17,6}{44}=0,4mol\Rightarrow m_C=0,4\cdot12=4,8g\)
\(n_{H_2O}=\dfrac{7,2}{18}=0,4mol\Rightarrow m_H=0,4\cdot2\cdot1=0,8g\)
Nhận thấy \(m_C+m_H=5,6< m_A=12g\)\(\Rightarrow\)có chứa oxi
\(m_O=12-5,6=6,4g\)
Gọi CTHH là \(C_xH_yO_z\)
\(x:y:z=\dfrac{m_C}{12}:\dfrac{m_H}{1}:\dfrac{m_O}{16}=\dfrac{4,8}{12}:\dfrac{0,8}{1}:\dfrac{6,4}{16}=0,4:0,8:0,4\)
\(\Rightarrow x:y:z=1:2:1\)
\(\Rightarrow CTĐGN\) là \(CH_2O\)
Gọi CTPT cần tìm là \(\left(CH_2O\right)_n\) (n\(\in\)N*)
Theo bài: \(40< M_A< 90\)
\(\Rightarrow40< 30n< 90\Rightarrow\dfrac{4}{3}< n< 3\Rightarrow n=2\)
Vậy CTPT A cần tìm là \(C_2H_4O_2\)
gửi lộn Hùng Nguyễn xóa giúp e