Cho 100 ml dung dich Naoh 1M vào dung dich X gồm:à mol NH4+,b mol Cl- và c mol NO3-( đun nong); thu đuoc 1.792lit khí (dktc) Các phản ứng điều xảy ra hoàn toan . Giá trị cua b+c la
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.n_{NaOH}=1.0,15=0,15\left(mol\right)\\ n_{KOH}=0,5.0,1=0,05\left(mol\right)\\ \left[Na^+\right]=\left[NaOH\right]=\dfrac{0,15}{0,15+0,1}=0,6\left(M\right)\\ \left[K^+\right]=\left[KOH\right]=\dfrac{0,05}{0,1+0,15}=0,2\left(M\right)\\ \left[OH^-\right]=0,2+0,6=0,8\left(M\right)\\ b.2KOH+H_2SO_4\rightarrow K_2SO_4+2H_2O\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\\ n_{H_2SO_4}=\dfrac{1}{2}.\left(n_{KOH}+n_{NaOH}\right)=\dfrac{0,15+0,05}{2}=0,1\left(mol\right)\\ a=C_{MddH_2SO_4}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)

Áp dụng định luật bảo toàn điện tích ta có:
0,01+0,1=2*0,01+x
<=>x=0,09(mol)
Nồng độ mol các ion trong dung dịch A là:
[H+]=\(\frac{0,01}{0,1}\)=0,1M
[Na+]=\(\frac{0,1}{0,1}\)=1M
[SO42-]=\(\frac{0,01}{0,1}\)=0,1M
[Cl-]=\(\frac{0,09}{0,1}\)=0,9M
mmuối khan=mH+ + mNa+ +mSO42- + mCl- =0,01*1 +0,1*23 +0,01*96 +0,09*35,5 =4,395(g)
\(n_{H^+}=n_{HNO_3}=V\)mol
\(n_{OH^-}=n_{NaOH}=0,5.0,2=0,1\) mol
\(H^++OH^-\rightarrow H_2O\)
0,1<--0,1
\(\Rightarrow n_{H^+}=V=0,1\)lít = 100 ml
\(NaOH+HNO_3\rightarrow NaNO_3+H_2O\)
0,1 -----> 0,1 ---------->0,1
\(NaNO_3\rightarrow Na^++NO_3^-\)
\(\Rightarrow\left[Na^+\right]=\left[NO_3^-\right]=\dfrac{0,1}{0,1+0,2}=0,33M\)


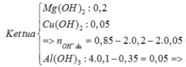
nNaOH = 0,1 (mol) , nNH3 = 0,08 (mol)
OH- + NH4+ -> NH3 + H2O
0,08......0,08.......0,08 (mol)
=> a = 0,08 (mol)
Bảo toàn điện tích trong dung dịch X ta được :
a=b+c=0,08 (mol)