hỗn hợp chứa 16,8 gam FeO và Cu phản ứng tối đa với 50mk H2SO4 2,OM ( loãng )
a) có khí nào thoát ra sau phản ứng không
b) tính %(m) FeO
c) tính khối lượng chất tan trong dung dịch sau pứ
làm giúp e mn ơii
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

Chọn đáp án B
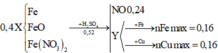
Y có thể gồm các ion thuộc 1 trong 3 trường hợp:
TH1: Fe2+ (có thể), Fe3+, H+, S O 4 2 -
TH2: Fe2+ (có thể), N O 3 - , S O 4 2 -
TH3: Fe3+, H+, N O 3 - , S O 4 2 -
Lượng Cu và Fe hoà tan tối đa là như nhau Þ Chỉ có thể là TH2 hoặc TH3 vì TH1 có H+ mà không
có N O 3 - Þ Tạo thêm H2, làm cho lượng Fe tối đa hoà tan được nhiều hơn Cu
nCu max = nFe max = 0,16 Þ Số mol Fe3+ trong Y tối đa = 0,16x2 = 0,32
Với TH3 thì nFe3+ = 0,4 Þ Chỉ có TH2 thỏa mãn Y
Trong đó Y chứa: Fe3+ (0,32 mol), Fe2+ (0,08 mol), N O 3 - , S O 4 2 - (0,52 mol)
BTĐT Þ nNO = 0,32x3 + 0,08x2 - 0,52x2 = 0,08
Bán phản ứng Þ nFeO = (0,52x2 - 0,24x4)/2 = 0,04
BTNT.N Þ nFe(NO3)2 = (0,24 + 0,08)/2 = 0,16 Þ nFe = 0,4 - 0,16 - 0,04 = 0,2
Vậy %Fe(NO3)2 = ![]()

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

Chọn đáp án D
Y có thể hoà tan được Cu và Fe sinh ra NO ⇒ Còn dư H+ và N O 3 - trong Y
⇒ Dung dịch Y gồm: Fe3+, H+, N O 3 - và S O 2 -

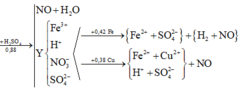
Y hoà tan tối đa 0,42 mol Fe nhưng chỉ hoà tan tối đa 0,38 mol Cu, sự chênh lệch này là do Cu không tác dụng với H+ tạo H2, đặt Z là dung dịch sau khi Y phản ứng với Cu


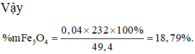

\(2Al+6HCl->2AlCl_3+3H_2\\ Fe+2HCl->FeCl_2+H_2\\ n_{Al}=a;n_{Fe}=b\\ 27a+56b=8,3\\ 1,5a+b=\dfrac{5,6}{22,4}=0,25\\ a=b=0,1\\ m_{Al}=27\cdot0,1=2,7g\\ m_{Fe}=8,3-2,7=5,6g\\ a=\dfrac{3a+2b}{500}\cdot36,5=3,65\%\\ m_{ddsau}=508,3-0,25\cdot2=507,8g\\ C\%_{AlCl_3}=\dfrac{133,5a}{507,8}=2,63\%\\ C\%_{FeCl_2}=\dfrac{127b}{507,8}=2,50\%\)

Khj cho B td H2SO4 ko co chat khj thoat ra chung to Al va Zn da pu het.
nCu(NO3)2=0,03=>nCu[+2]=0,03.
nAgNO3=0,01=>nAg+=0,01
goi x,y la so mol Al,Zn.
Al>Al[+3]+3e
Zn>Zn[+2]+2e
=>ne nhuog=3x+2y
Cu[+2]+2e>Cu
Ag+ + 1e>Ag
=>ne nhan=0,03.2+0,01=0,07
theo dlbt e=>3x+2y=0,07
27x+65y=1,57
=>x=0,01,y=0,02
=>nAl(NO3)3=0,01
=>mAl(NO3)3=2,13g
nZn(NO3)2=nZn[+2]=0,02=>mZn(NO3)2=3,78g
khoi luog Cu va Ag la=0,03.64+0,01.108=3g
=>kl dd giam la 3-1,57=1,43
=>kl dd luc sau la 101,43-1,43=100g
=>C%Al(NO3)3=2,13/100=2,13%
C%Zn(NO3)2=3,78%
PTHH: \(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
Không có khí thoát ra
Ta có: \(n_{H_2SO_4}=0,05\cdot2=0,1\left(mol\right)=n_{FeO}=n_{FeSO_4}\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{FeO}=\dfrac{0,2\cdot72}{16,8}\cdot100\%\approx85,71\%\\m_{FeSO_4}=0,2\cdot152=30,4\left(g\right)\end{matrix}\right.\)