Hòa tan hoàn toàn 49.6 gam hỗn hợp X gồm: Fe, FeO,Fe2O3,Fe3O4 bằng H2SO4 đặc nóng thu được dung dịch Y và 8.96 lít khí SO2.
a) Tính phần trăm khối lượng oxi trong hỗn hợp X.
b) Tính khối lượng muối trong dung dịch Y.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi X gồm Fe và O.
Ta có: 56nFe + 16nO = 49,6 (1)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
BT e, có: 3nFe - 2nO = 2nSO2 = 0,8 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,7\left(mol\right)\\n_O=0,65\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_O=\dfrac{0,65.16}{49,6}.100\%\approx20,97\%\)
Muối thu được là Fe2(SO4)3
BTNT Fe, có: \(n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Fe}=0,35\left(mol\right)\)
\(\Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,35.400=140\left(g\right)\)

Quy đổi hỗn hợp X thành Fe (a mol) và O (b mol)
Các quá trình nhường và nhận electron:
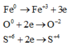
Theo định luật bảo toàn khối lượng ta có: 56a + 16b = 49,6 (1)
Theo định luật bảo toàn electron ta có: 0,4.2 + 2b = 3a (2)
(1) và (2) => a = 0,7; b = 0,65 (mol)
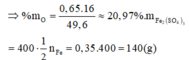
Đáp án A

Đáp án C
Ta có sơ đồ phản ứng
CO + Fe2O3 → Fe, FeO, Fe3O4, Fe2O3 + H2SO4 đặc → Fe2(SO4)3
Bảo toàn nguyên tố Fe ta có: nFe2(SO4)3= nFe2O3= 16/160 = 0,1 mol
→mFe2(SO4)3= 0,1.400= 40 gam

Đáp án B
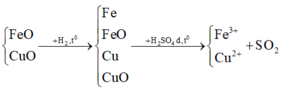
Xét toàn bộ quá trình:
Số oxi hóa của sắt tăng từ +2 lên +3
Số oxi hóa của đồng không thay đổi
Số oxi hóa của hidro tăng từ 0 lên +1
Số oxi hóa của lưu huỳnh giảm từ +6 xuống +4
Áp dụng định luật bảo toàn mol electron cho toàn bộ quá trình ta được:
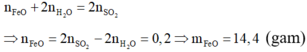
Đối vs bài này ta quy đổi hỗn hợp X thành 2 phần là Fe và O
nên m(hỗn hợp) =mFe+mO=49,6g. (1)
Btoàn e ta có:
Fe--> Fe(+3) +3e; O2 +4e---> 2O(-2) ;
S(+6)---> S(+4) +2e;
---> 3*nFe+ 2*nSO2=2*nO =2*nO - 0,8; (2)
từ (1) và (2) ta có mO=19.36(g);mFe= 30,24(g);
a) %O=19,36/49,6 =39,03%;
b) bảo toàn nguyên tố Fe ta có:
nFe2(SO4)3 =2nFe=2*30,24/46=1,08 mol;
khối lượng muối trong ddY là 1,08*(56*2+96*3)=432 g.