Phân hủy hoàn toàn 21,4g một hợp chất A thì thu đc Sắt ( III ) oxit ( Fe2O3) và hơi nước theo tỷ lệ về số mol là 1 :3. a, tính số gam Sắt ( III ) oxit ( Fe2O3) và hơi nước thu đc. b, xác định CTHH của hợp chất A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số hơi xấu ._. Mình thấy mình làm đúng rồi đó. Nhưng bạn cứ xem lại xem sao nhé!


Bài 4 câu a đề là thể tích H2 nha bạn
a)\(Fe2O3+3H2-->2Fe+3H2O\)
\(n_{Fe2O3}=\frac{12}{160}=0,075\left(mol\right)\)
\(n_{H2}=3n_{Fe2O3}=0,225\left(mol\right)\)
\(V_{H2}=0,225.22,4=5,04\left(l\right)\)
b)\(n_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\)
\(m_{Fe}=0,15.56=8,4\left(g\right)\)
Bài 6
a)\(Zn+H2SO4-->ZnSO4+H2\)
\(n_{Zn}=\frac{19,5}{65}=0,3\left(mol\right)\)
\(n_{ZnSO4}=n_{Zn}=0,3\left(mol\right)\)
\(m_{ZnSO4}=0,3.162=48,3\left(g\right)\)
b)\(n_{H2}=n_{Zn}=0,3\left(mol\right)\)
\(V_{H2}=0,3.22,4=6,72\left(l\right)\)

Đáp án B
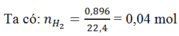
Gọi: nNa = x mol ⇒ nAl = 2x mol
Phản ứng:
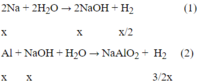
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2)
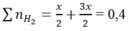
![]()
⇒mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol ⇒ nAl dư = 0,4 - 0,2 = 0,2 mol
⇒mAl = 0,2.27 = 5,4 (g)

Đáp án C
Ta có: nH2= 0,04 mol
Gọi: nNa = x mol " nAl = 2x mol
Phản ứng:
2Na + 2H2O → 2NaOH + H2 (1)
x x x 2
Al + NaOH + H2O → NaAlO2 + 3 2 H2 (2)
x x 3 2 x
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1) ; (2)

⇒ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol ⇒ nAl dư = 0,4 - 0,2 = 0,2 mol
⇒ mAl = 0,2.27 = 5,4 (g)

M(Y)=19x2=38(đvC) =>nNO=nNO2=0,0175(mol)
BTe:3x=4nO2+0,0175.3+0,0175.1
=>nO2=(3x-0,07)/4
BTKL: mFe+mO2=m(A) <=> 56x+(3x-0,07).32/4=5,04
<=> x=0,07 (mol )

Chọn C.
(a) Sai, X có thể là xicloankan.
(b) Đúng.
(c) Đúng.
(d) Sai, ví dụ HCOOH và C2H5OH có cùng M = 46 nhưng không phải đồng phân.
(e) Sai, phản ứng hữu cơ thường xảy ra chậm.
(g) Sai, chất này có k = 2, để chứa vòng benzen thì
(h) Sai, phenol có tính axit yếu nên không đổi màu quỳ tím.