Phản ứng hóa học xảy ra khi cồn cháy (đèn cồn trong phòng thí nghiệm) là
Rượu etylic (C2H5OH) + oxi cacbonic (CO2) + nước
1) Hãy lập phương trình hóa học của phản ứng.
2) Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học.
3) Tính tỉ lệ về khối lượng giữa các chất trong phản ứng hóa học.
4) Tính thể tích khí oxi cần thiết để đốt cháy hết 4,6 gam rượu etylic và thể tích khí cacbonic tạo thành ở điều kiện tiêu chuẩn.


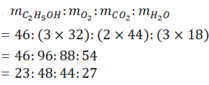
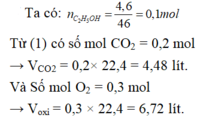

1. PTHH: C2H5OH + 3O2 =(nhiệt)=> 2CO2 + 3H2O
2. Tỉ lệ số phân tử: 1 : 3 : 2 : 3
3. Tỉ lệ về khối lượng: mC2H5OH : mO2 : mCO2 : mH2O = 46 : 96 : 88 : 54
4. nC2H5OH = \(\dfrac{4,6}{46}=0,1\left(mol\right)\)
=> nO2 = 0,3 (mol) , nCO2 = 0,2 (mol)
=> VO2(đktc) = 0,3 x 22,4 = 6,72 (lít), VCO2(đktc) = 0,2 x 22,4 = 4,48 (lít)
1/ C2H5OH + 3O2 −to→ 2CO2 + 3H2O (1)
2/ Tỉ lệ số phân tử C2H5OH: số phân tử O2: số phân tử CO2: số phân tử H2O = 1 : 3 : 2 : 3
3/ mC2H5OH ∶ mO2 ∶ mCO: mH2O = 46 : (3x32) : (2x44) : (3x18)
= 46 : 96 : 88 : 54
4/ Ta có : nC2H5OH= 4,6/46 = 0,1 (mol)
Từ (1) → nCO2=0,2 (mol) → VCO2= 0,2.22,4 = 4,48 (lít)
Từ (1) → nO2= 0,3 (mol) → VO2= 0,3.22,3 = 6,72 (lít)