Hoà tan một lượng muối cacbonat của kim loại hoá trị III bằng dung dịch H2SO4 nồng
độ 16%. Sau khi khí không thoát ra nữa, thu được dung dịch chứa 20% muối sunfat tan. Xác
định kim loại đó.
GIÚP MÌNH VỚI Ạ!!!!!!!!!!!!!!!!!!!!!!!!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi CT của muối cacbonat là MCO3.
Giả sử có 100g H2SO4,nH2SO4=0,15mol
MCO3+H2SO4=MSO4+CO2+H2O
0,15 0,15 0,15 0,15
(H2SO4 hết vì sau pư còn chất rắn ko tan là MCO3)
mddsaupư=mddH2SO4bđ+mMCO3-mCO2=100+0,1... (gam)
C%MSO4=mMSO4x100/mdd
suy ra:0,15(M+96)/(102,4+0,15M)=0,17 suy ra M=24 nên M là Mg

Gọi công thức muối cacbonat cần tìm là MCO3
giả sử có 1 mol H2SO4 phản ứng
MCO3 + H2SO4 ---> MSO4 + CO2 + H2O
1 <--- 1 --> 1 1
m H2SO4 = 1.98 = 98g---> m dung dịch H2SO4 = (98 . 100)/ 16 = 612,5 g
m MCO3 = M + 60
m CO2 = 1. 44=44 g
m dds pứ = mMCO3 + mH2SO4 - m CO2
= M + 60 + 612,5 - 44
= M + 628,5 g
C% = ( m MSO4 / m dds pứ ) .100= 22,2%
hay ( M+96 / 628,5) .100 = 22,2%
--> M = 56 (1)
và M là hóa trị 2 (2)
---> M là sắt ( Fe = 56 , hóa trị 2)
---> công thức phân thức của muối là FeCO3
Gọi M là kim loại cần tìm
vì chất khí không thoát ra, vẫn còn chất rắn không tan, muối sunphat tan => H2SO4 hết, muối cacbonet còn dư
Giả sử có 1 mol axit phản ứng
MCO3 + H2SO4 --> MSO4 + H2O + CO2
1 <------ 1 --------> 1 --------------> 1
khối lượng muối sunphat = (M+96).1
khối lượng dd sau phản ứng = khối lượng dd axit + khối lượng muối cacbonat đã phản ứng - khối lượng CO2 thoát ra = 1.98.100/14,7 + (M+60).1 - 1.44 = M + 682,67
C% muối sunphat = %
=> M = 24 => M là Mg

tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
⇒nH2SO4=100.9,8%98=0,1(mol)⇒nH2SO4=100.9,8%98=0,1(mol)
Gọi CTHH của muối cacbonat kim loại R hóa trị n là R2(CO3)nR2(CO3)n
R2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2OR2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2O
Theo phương trình ,ta có :
nCO2=nH2SO4=0,1(mol)nCO2=nH2SO4=0,1(mol)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%
⇒R=28n⇒R=28n
Với n=1n=1 thì R=28R=28(loại)
Với n=2n=2 thì R=56(Fe)R=56(Fe)
Với n=3n=3 thì R=84R=84(loại)
Vậy kim loại R hóa trị n là FeFe hóa trị II

Đáp án A
Vì chưa biết lương Ba(OH)2 dư hay thiếu => có 2 trường hợp
* TH1: khi Ba(OH)2 dư, tính theo lượng kết tủa
Gọi công thức muối là MCO3
CO2 + Ba(OH)2 → BaCO3 + H2O
0,042 0,042
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,042 0,042
Mmuối = M+ 60 = 4,2/0,042=100 => M = 40 (Ca)
* TH2: khi Ba(OH)2 thiếu , Ba(OH)2 hết, 1 phẩn kết tủa bị hòa tan
CO2 + Ba(OH)2 → BaCO3 + H2O
0,046 0,046
nkết tủa bị hòa tan = 0,046- 0,042=0,004
BaCO3 + CO2 + H2O → Ba(HCO3)2
0,004 0,004
=> nCO2 = 0,004+ 0,0046=0,05
MCO3 +2 HCl → MCl2 + CO2 + H2O
0,05 0,05
Mmuối = M+ 60 = 4,2/0,05 = 84 => M = 24 (Mg)
Chú ý: Xét 2 trường hợp

\(n_{CO_2}=\dfrac{0.896}{22.4}=0.04\left(mol\right)\)
\(\Rightarrow n_{HCl}=0.04\cdot2=0.08\left(mol\right)\Rightarrow m_{HCl}=0.08\cdot36.5=2.92\left(g\right)\)
\(\Rightarrow n_{H_2O}=0.04\left(mol\right)\Rightarrow m_{H_2O}=0.04\cdot18=0.72\left(g\right)\)
\(BTKL:\)
\(m_{Muối}=3.34+2.92-0.04\cdot44-0.72=3.78\left(g\right)\)

RO+H2SO4→ RSO4+H2O (1)
RCO3+H2SO4→ RSO4+CO2+H2O (2)
Đặt a là khối lượng hỗn hợp X.
x,y là số mol RO và RCO3
Ta có : (R+16)x+(R+60)y=a (*)
Từ (1) và (2) \Rightarrow (R+96)(x+y)=1,68a (**)
Từ (2) \Rightarrow y=0,01a (***)
Giải (*),(**) và (***) \Rightarrow x=0,004a : R=24
Vậy R là Mg

23.8g MCO3+2HCL=>CO2 +MCL2 +H2O
nCO2=0.2mol
mMCL2=mM+mCL=23.8+0.2*2*35.5-0.2*44=29.2g
nCO2=4,48/22,4=0,2mol.
gọi muối 1 là A=)ct muối :A2CO3
------------2 là B=) ct muối :BCO3.
gọi mol muối 1 là x muối 2 là y
htan=hcl ta được:
A2CO3 + 2HCL==>2ACL+CO2+H2O
x => 2x => 2x => x =>x
BCO3 + 2HCL ==> BCL2 + CO2 + H2O
y => 2y => y => y => y
ta nhận thấy mol hỗn hợp 2 muối ban đầu bằng mol khí co2 thoát ra bằng mol h2o thu được.
mà mol co2 là 0,2 mol (1) => mol hỗn hợp muối cacbobat=0,2; mol h20=0,2mol.
có mol hcl = 2x+2y=2.(x+y)=2.0,2=0,4mol
theo ĐLBTKL ta có:
mhh+ mhcl= m muối mới( cần tìm)+m CO2 +m H2O
m muối mới= 23,8+ 0,4.36,5-0,2.44-0,2.18=26g
vậy kl muối là 26g . sai thì đừng ném gạch nhau

Gọi công thức oxit của kim loại hóa trị III là A2O3,ta có các phương trình sau
A2O3+3H2SO4--->A2(SO4)3+3H2O (1)
0,02<--0,06<---------0,02
Vì sau phản ứng (1) dung dịch còn có thể phản ứng với CaCO3 giải phóng khí CO2=>axit H2SO4 dư,ta có phương trình
H2SO4+CaCO3--->CaSO4+CO2+H2O (2)
0,01<-----0,01--------0,01<-----0,01
nCO2=0,224:22,4=0,01 mol
Khối lượng muối A2(SO4)3 sau khi cô cạn là
9,36-0,01x(40+96)=8 g
Ta thấy rằng A2O3=3,2 g,sau phản ứng tạo thành muối A2(SO4)3=8g Như vậy khối lượng tăng thêm là do 3 gốc -SO4 thay thế cho 3 nguyên tử Oxi,vậy khối lượng tăng thêm là 8-3,2 =4,8 g
nA2SO4=4,8:(96x3-16x3)=0,02 mol
=>khối lượng muối=0,02x(2xR+96x3)=8
=>R=56
R hóa trị III, có M=56=>R là Fe,công thức oxit là Fe2O3
nH2SO4=0,01+0,06=0,07 mol
mH2SO4=0,07x98=6,86g
C% đ H2SO4=(6,86:200)x100%=3,43%

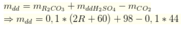
\(Đặt.muối:A_2\left(CO_3\right)_3\\ n_{A_2\left(CO_3\right)_3}=a\left(mol\right)\Rightarrow n_{H_2SO_4}=3a\left(mol\right)\\ m_{ddH_2SO_4}=\dfrac{3a.98.100}{16}=1837,5a\left(g\right)\\ A_2\left(CO_3\right)_3+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3CO_2+3H_2O\\ m_{ddsau}=\left(M_A.2+180\right).a+1837,5a-44a.3=1885,5a+2M_A.a\left(g\right)\\ Vì:C\%_{dd.muối.sunfat}=16\%\\ \Leftrightarrow\dfrac{\left(2M_A+288\right).a}{\left(1885,5+2M_A\right).a}.100\%=16\%\\ \Leftrightarrow M_A=8,14\left(loại\right)\)
Không có kim loại thỏa