cho 31,84g hh NaX, NaY ( X và Y là hai halogen) vào dd AgNO3 dư thu đc 57,34g kết tủa. Tìm công thức NaX và NaY
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A.
Hỗn hợp (NaX, NaY) = NaM
NaM + AgNO3 → AgM↓+NaNO3
Ta có
![]() => M = 81,6 => X,Y lần lượt là Br (80) và I (127)
=> M = 81,6 => X,Y lần lượt là Br (80) và I (127)

TH1: NaF và NaCl
Kết tủa chỉ có AgCl
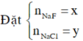
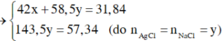
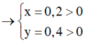
Vậy CT 2 muối có thể là NaF và NaCl
TH2: Hỗn hợp muối không chứa NaF
Đặt CT chung của 2 muối ban đầu là NaX
![]()
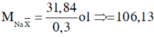
=> 2 muối là NaBr và NaI
Đáp án A

Cái chỗ M đó suy ra là \(M_X< 83,13< M_Y\)
Thì có 2 chất liên tiếp là Br (80) và I (127)

Đáp án C
Gọi công thức chung của NaX và NaY là NaM.
NaM + AgNO3 → AgM↓+NaNO3
0,03 →0,03 (mol)
![]()
=> M = 50,3 => X,Y lần lượt là Cl và Br

(Bài này giải như bình thường thôi. Nhưng lưu ý với bạn là nếu có 1 muối là NaF thì muối này ko tạo kết tủa với AgNO3 đâu)
* Trường hợp 1: Ko có muối NaF
Gọi công thức tổng quát chung hai muối là: NaX.
Phương trình hoá học viết được:
NaX + AgNO3 = AgX + NaNO3
(23+X) (108+X) (g)
31,84 57,34
=> X=83,13 => Hai halogen là: Bx và I.
* Trường hợp 2: ! trong hai muối là NaF (giả sử là NaX)
Lúc đó chỉ có NaY phản ứng (chỉ có 3 khả năng: Cl, Br hoặc I thôi nên thử từng khả năng cũng được) => đáp án: Cl
Vậy 2 muối là NaF và NaCl hoặc NaBr và NaI.

\(NaM+AgNO_3\rightarrow AgM+NaNO_3\)
\(n_{NaM}=n_{AgM}\)
\(\Leftrightarrow\frac{15,92}{23+M_M}=\frac{28,67}{108+M_M}\)
\(\Rightarrow M_M=83,333\)
\(\Rightarrow\) X là Brom(Br) ;Y là Iot(I)
Vậy NaX là NaBr và NaY là NaI


Nếu AgX và AgY đều kết tủa thì ta có:
NaX + AgNO3 -> AgX ↓ + NaNO3 (1)
a...........................a (mol)
NaY + AgNO3 -> AgY ↓ + NaNO3 (2)
Ta có hệ pt: \(\left\{{}\begin{matrix}\left(23+X\right)a+\left(23+Y\right)b=31,84\left(I\right)\\\left(108+X\right)a+\left(108+Y\right)=57,34\left(II\right)\end{matrix}\right.\)
Giải hệ pt ta đc: a + b = 0,3 (III)
Từ (I) => aX + bY = 24,94 (IV)
Gọi \(\overline{X}\) là khối lượng nguyên tử trung bình của X, Y, ta có:
\(\overline{X}\)=\(\dfrac{m_{hh}}{n_{hh}}=\dfrac{24,94}{0,3}=83,13\)
Vì X < \(\overline{X}\) < Y => X < 83,13 < Y
X = 80 < 83,13 nên X là brom và Y = 127 > 83,13 nên Y là iot
Vậy công thức của hai muối là NaBr và NaI
Đặt công thức hóa học 2 muối là NaZ.
Trong đó X<Z<Y
PHƯƠNG TRÌNH LÀ:
NaZ+AgNO3===>NaNO3+AgZ
Theo bài:
31,84/( 23+Z)=57,34/(108+Z)
Giải pt ta được Z=83,3333
Vì X,Y 2 chu kì liên tiếp=> X=Br Y=I.