Cho 5,6l hỗn hợp X gồm N2 và CO2 đi chậm qua 5 lít dd Ca(OH)2 0,02M để pư xảy ra hoàn toàn thu dc 5 gam kết tủa. Tính tỉ khối hơi của hỗn hợp X so với H2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Số mol hỗn hợp khí X: n(X) = n(N2) + n(CO2) = 5,6/22,4 = 0,25mol
n[Ca(OH)2] = 5.0,02 = 0,1mol
n(CaCO3) = 5/100 = 0,05mol
Ca(OH)2 + CO2 → CaCO3 + H2O
0,05______0,05____0,05
Ca(OH)2 + 2CO2 → Ca(HCO3)2
0,05_______0,1_______0,05
Số mol mỗi khí trong X
n(CO2) = 0,05+0,1=0,15mol
n(N2) = 0,25-0,15 = 0,1mol
Khối lượng hỗn hợp X: m(X) = m(N2) + m(CO2) = 28.0,1 + 44.0,15 = 9,4g
→ M(X) = 9,4/0,25 = 37,6 → Tỉ khối d(X/H2) = 37,6/2 = 18,8
Bài này có 2 TH:
TH1: Sp chỉ chứa muối trung hòa
Ca(OH)2 + CO2 → CaCO3 + H2O
\(\Rightarrow n_{CO2}=n_{CaCO3}=0,05mol\)
(% khí em tự tính nhé)
TH2: Sp chứa muối trung hòa và muối axit (như em đã giải ở trên).

n(Ca(OH)2) = 0,1 mol; n(CaCO3) = 0,05.
TH1: CO2 thiếu
CO2 + Ca(OH)2 → CaCO3 + H2O.
→ n(CaCO3) = n(CO2) = 0,05.=> n(N2) = 0,25 – 0,05 = 0,2.
Nên dX/H2 =\(\dfrac{0,05.44+0,2.28}{0,25.2}\) = 15,6. Không có đáp án nào.
TH2: CO2 phản ứng hết,
CO2 + Ca(OH)2 → CaCO3 + H2O.
0,05 0,05 0,05
2CO2 + Ca(OH)2 → Ca(HCO3)2
0,1 ← (0,1 – 0,05)
=> n(CO2) = 0,15 => n(N2) = 0,25 – 0,15 = 0,1.
Nên dX/H2 =\(\dfrac{0,15.44+0,1.28}{0,25.2}\) = 18,8. Thỏa mãn.

Phương pháp:
- Tính số mol CO và H2.
- m↓ - mCO2 = m dung dịch giảm => mCO2
- Viết PTHH. Tính toán theo PTHH.
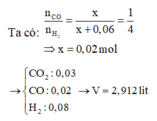
Đáp án C

Đáp án C
- Khi X + Ca(OH)2 thì chỉ có CO2 phản ứng:
=> mdung dịch giảm = mCaCO3 – mCO2 => mCO2 = 2 – 0,68 = 1,32g
=> nCO2 = 1,32: 44 = 0,03 mol
- Xét phản ứng ban đầu:
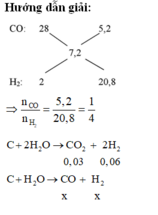
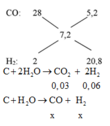
C + H2O → CO + H2
Mol x → x → x
C +2H2O → CO2 + 2H2
Mol 0,03 → 0,06
Vậy hỗn hợp khí cuối cùng gồm: x mol CO và (x + 0,06) mol H2
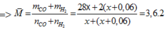
=> x = 0,02 mol
nKhí bđ = nCO2 + nCO + nH2 = 0,03 + 0,02 + 0,08 = 0,13 mol
=> Vkhí = 0,13.22,4 = 2,912 lit

Đáp án C
- Khi X + Ca(OH)2 thì chỉ có CO2 phản ứng:
=> mdung dịch giảm = mCaCO3 – mCO2 => mCO2 = 2 – 0,68 = 1,32g
=> nCO2 = 1,32: 44 = 0,03 mol
- Xét phản ứng ban đầu:
C + H2O → CO + H2
Mol x → x → x
C +2H2O → CO2 + 2H2
Mol 0,03 → 0,06
Vậy hỗn hợp khí cuối cùng gồm: x mol CO và (x + 0,06) mol H2
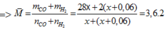
=> x = 0,02 mol
nKhí bđ = nCO2 + nCO + nH2 = 0,03 + 0,02 + 0,08 = 0,13 mol
=> Vkhí = 0,13.22,4 = 2,912 lit

Đáp án C
Phương pháp:
- Tính số mol CO và H2.
- m↓ - mCO2 = m dung dịch giảm => mCO2
- Viết PTHH. Tính toán theo PTHH.
Hướng dẫn giải:
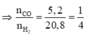
Ta có:



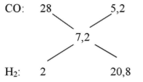
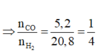
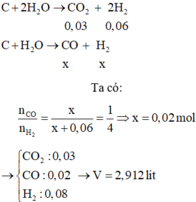

ta có n X= 0,25 mol, n Ca(OH)2 = 0,1 mol
m CaCO3 = 0,05 mol => n CO2 = 0,1.2 - 0,05 = 0,15 mol => n N2 = 0,1 mol
=> M = (0,1.28 + 0,15.44)/0,25 = 37,6
=> tỉ khối so với H2 = 18,8
Chỗ nCO2 đó là như thế nào vậy bạn