Cho 22,1 gam hỗn hợp gồm Mg, Fe, Zn tác dụng với H2SO4 dư thu được 12,3 lít H2 ở đktc và dung dịch Muối B.
a. Tính % mỗi kim loại trong hỗn hợp. Biết thể tích H sinh ra do Mg gấp 2 lần do Fe tạo ra.
b. Đem cô cạn dung dịch B thu được bao nhiêu gam Muối khan.


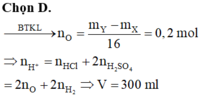
Mg+ H2SO4---------> MgSO4+H2 (1)
mol: 2a////////////////////////////////2a//////2a
Fe+ H2SO4 ----------> FeSO4+H2 (2)
mol: a/////////////////////////////////a////////a
Zn+ H2SO4-----------> ZnSO4+H2 (3)
mol: b////////////////////////////////b//////////b
nH2=0,55 mol ( Đề cho 12,3 tính ra lẻ nên mk cho V = 12,32 cho chẵn )
Đặt a; 2a; b lần lượt là số
mol của nH2(1), nH2(2),nH2(3)
Ta có PTKL : mhh= 24*2a+56a+65b=21,1 <=>104a+65b=21,1 (I)
Và nH2=2a+a+b=0,55<=>3a+b=0,55(II)
Giải hệ (I); (II) ta được mFe=a=0,15=> 2a=0,3=nMg
mZn= b=0,1
Do đó %mMg=\(\dfrac{24\cdot0,3\cdot100}{22,1}\)=32,58%
%mFe=\(\dfrac{56\cdot0,15\cdot100}{22,1}\)=38,01%
%mZn=29,41%
b)m =mMgSO4+mFeSO4+mZnSO4=0,3*120+0,15*152+0,1*161=74,9(g)