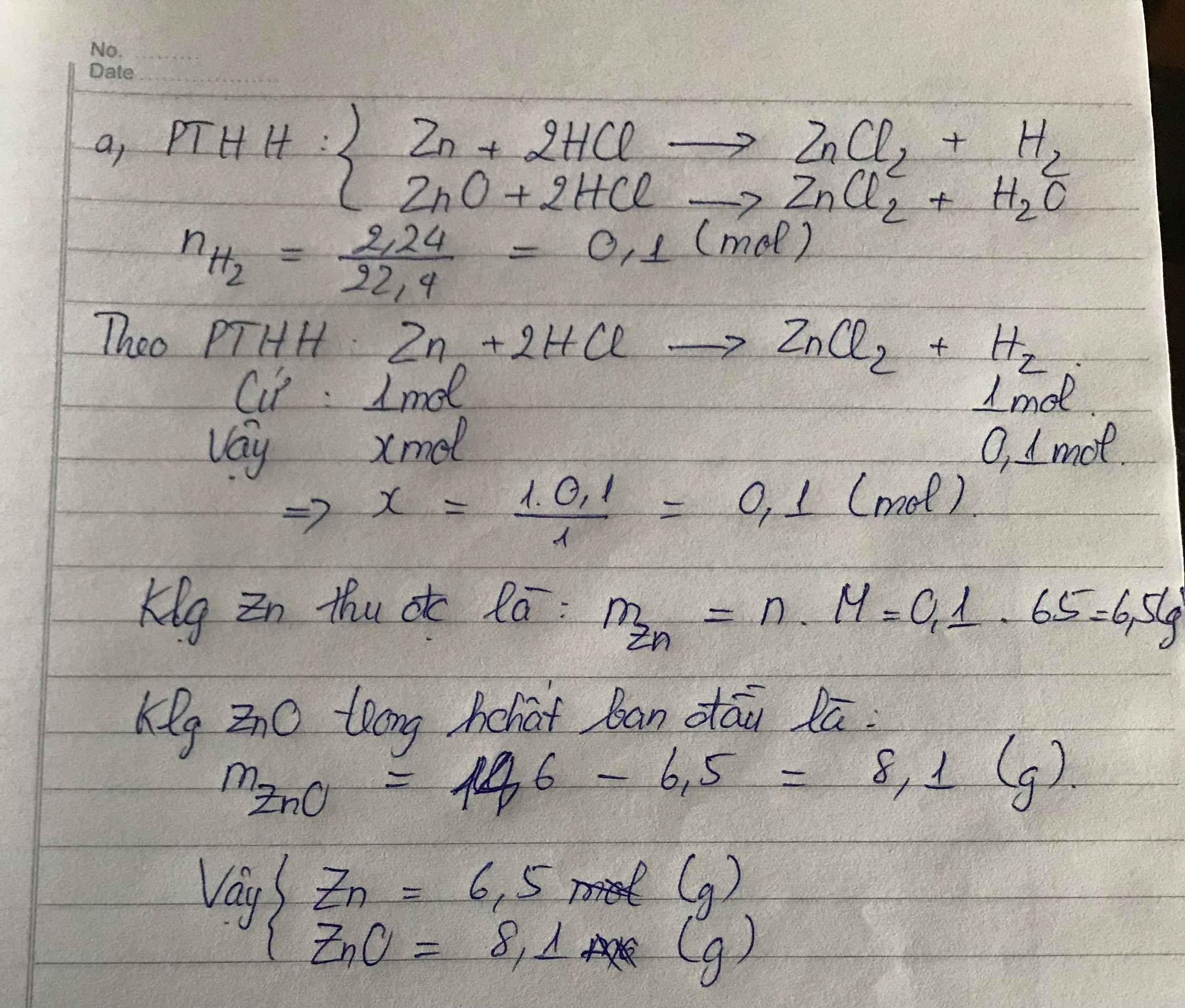Hòa tan 1,62g ZnO bằng 109,5 g HCl 10℅. Tính nồng độ ℅ các chất sau phản ứng Giải chi tiết giúp em ạ. Em cần gấp ạ. Cảm ơn mn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{ZnO}=\dfrac{1,62}{81}=0,02\left(mol\right)\)
\(m_{HCl}=109,5.10\%=10,95\left(g\right)\Rightarrow n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
PTHH: ZnO + 2HCl → ZnCl2 + H2O
Mol: 0,02 0,3 0,02
Ta có: \(\dfrac{0,02}{1}< \dfrac{0,3}{1}\) ⇒ ZnO hết, HCl dư
mdd sau pứ = 1,62+109,5 = 111,12 (g)
\(C\%_{ddZnCl_2}=\dfrac{0,02.136.100\%}{111,12}=2,45\%\)
\(C\%_{ddHCl}=\dfrac{\left(0,3-0,04\right).36,5.100\%}{111,12}=8,54\%\)
\(n_{ZnO}=\dfrac{1,62}{81}=0,02\left(mol\right)\)
\(m_{HCl}=109,5.10\%=10,95\left(g\right)\Rightarrow n_{HCl}=\dfrac{10,95}{36,5}=0,3\left(mol\right)\)
PTHH: ZnO + 2HCl → ZnCl2 + H2
Mol: 0,02 0,04 0,02 0,02
Ta có: \(\dfrac{0,02}{1}< \dfrac{0,3}{2}\) ⇒ ZnO hết, HCl dư
mdd sau pứ = 1,62+109,5-0,02.2 = 111,08 (g)
\(C\%_{ZnCl_2}=\dfrac{0,02.136.100\%}{111,08}=2,45\%\)
\(C\%_{HCldư}=\dfrac{\left(0,3-0,04\right).36,5.100\%}{111,08}=8,54\%\)

\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,3 0,6 0,3 0,3
\(a,V_{H_2}=0,3.22,4=6,72\left(l\right)\)
\(b,m_{HCl}=0,6.36,5=21,9\left(g\right)\)
\(m_{ddHCl}=\dfrac{21,9.100}{21,90}=100\left(g\right)\)
\(c,m_{FeCl_2}=127.0,3=38,1\left(g\right)\)
\(m_{ddFecl_2}=\left(16,8+100\right)-0,3.2=116,2\left(g\right)\)
\(C\%_{ddFeCl_2}=\dfrac{38,1}{116,2}.100\%\approx37,79\%\)

\(n_{Zn}=\dfrac{130}{65}=2mol\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=n_{H_2}=2mol\\ V_{H_2}=2.22,4=44,8l\\ 1000ml=1l\\ n_{HCl}=2.2=4mol\\ C_{M_{HCl}}=\dfrac{4}{1}=4M\)
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{130}{65}=2mol\)
PTHH: Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
TL; 1 2 1 1
mol: 2 \(\rightarrow\) 4
\(m_{HCl}=n.M=4.36,5=146g\)
đổi 1000 ml= 1l
\(C\%_{ddHCl}=\dfrac{m_{HCl}}{V_{HCl}}.100\%=\dfrac{146}{1}.100=14600\%\)
số hơi lớn em xem lại đề nhé

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(m_{HCl}=245.16,7\%=40,915\left(g\right)\Rightarrow n_{HCl}=\dfrac{40,915}{36,5}=1,121\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{1,121}{2}\), ta được HCl dư.
Theo PT: \(\left\{{}\begin{matrix}n_{FeCl_2}=n_{H_2}=n_{Fe}=0,1\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{Fe}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ nHCl dư = 1,121 - 0,2 = 0,921 (mol)
Ta có: m dd sau pư = 5,6 +245 - 0,1.2 = 250,4 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{FeCl_2}=\dfrac{0,1.127}{250,4}.100\%\approx5,07\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,921.36,5}{250,4}.100\%\approx13,43\%\end{matrix}\right.\)

250ml = 0,25 lít
\(n_{Na_2O}=\dfrac{3,1}{62}=0,05mol\)
\(Na_2O+H_2O\rightarrow2NaOH\)
0,05 0,1 ( mol )
\(C_{MNaOH}=\dfrac{0,1}{0,25}=0,4M\)