a) Hòa tan một lượng muối CO3 của một kim loại hóa trị II bằng dung dịch H2SO4 14,7%. Sau khi kết thúc phản ứng, khí không còn thoát ra nữa thì còn lại dung dịch 175 muối sunfat. Xác định nguyên tử khối của kim loại.
b) Lấy 40g dung dịch bão hòa của muối FeCl2, thêm vào đó 10g muối FeCl2 khan. Đun nóng để hòa tan hết. Khi để nguội đến khối lượng ban đầu thì lắng xuống 23,4g muối tinh thể hidrat. Xác định công thức của tinh thể biết rằng dung dịch bão hòa chứa 38,5% muối khan.



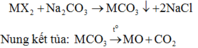
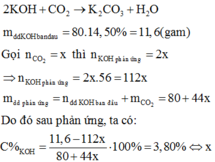 = 0,75
= 0,75
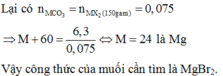


vì chất khí không thoát ra, vẫn còn chất rắn không tan, muối sunphat tan => H2SO4 hết, muối cacbonet còn dư
Giả sử có 1 mol axit phản ứng
MCO3 + H2SO4 --> MSO4 + H2O + CO2
1 <------ 1 --------> 1 --------------> 1
khối lượng muối sunphat = (M+96).1
khối lượng dd sau phản ứng = khối lượng dd axit + khối lượng muối cacbonat đã phản ứng - khối lượng CO2 thoát ra = 1.98.100/14,7 + (M+60).1 - 1.44 = M + 682,67
C% muối sunphat = (M+96)/(M+682.67)*100% = 17%
=> M = 24 => M là Mg b) Gọi công thức muối hiđrat là:FeCl2.xH2O --->mFeCl2.xH2O = 24,3(g)
trong dung dịch bão hòa ban đầu: mFeCl2 = 40*38,5% = 15,4g
Vì dung dịch ban đầu đã bão hòa nên 10g FeCl2 thêm vào sau khi đưa về nhiệt độ cũ sẽ kết tinh
Khi đưa về nhiệt độ ban đầu thì khối lượng dung dịch = 40 + 10 - 24,3 = 25,7
----->mFeCl2 = 25,7*38,5% = 9,8945
----->mFeCl2(trong tinh thể) = 10 + 15,4 - 9,8945 =15,5055
------->nFeCl2 = 15,5055/127 = 0,122 mol
----->nFeCl2.xH2O = nFeCl2 = 0,122mol
----->MFeCl2.xH2O = 24,3/0,122 = 199
------->127 + 18x = 199 ------>x = 4
Vậy công thức muối hidrat là : FeCl2.4H2O
tại sao n FeCl2.xH2O = nFeCl2