hợp chất M được tạo thành từ cation X+ và anion Y3- mỗi ion đều do 5 ng tử của 2 nguyên tố phi kim tạo nên. Biết tổng số proton trong X+ bằng 11 và trong Y3- là 47. Hai nguyên tố trong Y3- thuộc 2 chu kì kế tiếp nhau trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị. Hợp chất đó là gì
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tìm cation X+: Ta sẽ làm một bài hóa nhỏ: “Hợp chất X do 5 nguyên tố phi kim loại tạo nên, biết rằng tổng số proton trong X là 11. Tìm X”
+ Để cho dữ liệu gồm tổng số proton và tổng số nguyên tố tạo nên vì vậy ta sẽ nghĩ ngay đến trị số proton trung bình từ đó ta có: Z ¯ = 11 5 = 2 , 2 ⇒ Phải có 1 nguyên tố có số proton bé hơn 2 Chỉ có thể là H (do He là khí hiếm)
Gọi X là AHy theo giả thiết ta có:
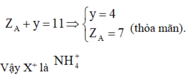
Tìm anion Y3- : Tương tự ta cũng sẽ làm bài hóa nhỏ sau: “Hợp chất Y do 5 nguyên tố phi kim thuộc 2 chu kỳ kế tiếp trong bảng tuần hoàn và có số thứ tự cách nhau 7 đơn vị tạo nên. Biết rằng tổng số proton trong Y là 47. Tìm Y”
Tương tự chúng ta cũng sẽ khai thác trị số proton trung bình:
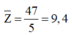
Do đó phải có 1 nguyên tố có số proton nhỏ hơn 9,4 (chu kỳ 2 hoặc 1).
Mặt khác theo giả thiết ta có 2 nguyên tố phi kim tạo nên Y thuộc 2 chu kỳ liên tiếp
=> Hai nguyên tố đó thuộc chu kỳ 2 và chu kỳ 3.
Chu kỳ 3 có các phi kim Si(14); P(15); S(16); 17 (Cl)
Từ đó ta suy ra được các cặp là (Si – N); (P – O); (S – F).
Dễ dàng nhận thấy cặp thỏa mãn là (P – O) với ion P O 4 3 -
Vậy Z là (NH4)3PO4 từ đó ta có:
A: Đúng: Phân tử khối của Z là 133
B: Đúng: Trong Z chỉ chứa liên kết ion (giữa và ) và liên kết cộng hóa trị (giữa N và H; giữa P và O)
C: Đúng: Z chứa ion nên Z phản ứng được với NaOH theo phương trình
![]()
D: Sai: Z phản ứng được với AgNO3 tạo kết tủa Ag3PO4 (màu vàng)
Đáp án D.

D
Xét ion X + : có 5 nguyên tử, tổng số proton là 11. Vậy số proton trung bình là 2,2.
=> Có 1 nguyên tử có số proton nhỏ hoặc bằng 2 và tạo thành hợp chất. Vậy nguyên tử đó là H

Số electron trung bình của các nguyên tử trong Y 2 - là 9,6
=> Có 1 nguyên tử có số electron nhỏ hơn 9,6
=> Nguyên tử của nguyên tố thuộc chu kì 2.
=> Nguyên tử của nguyên tố còn lại thuộc chu kì 3.
Nếu 2 nguyên tố cùng thuộc một nhóm A thì sẽ hơn kém nhau 8 electron


Theo 4 đáp án X+ là NH4+
ion Y 2- có tổng số e là 50 và do 2 nguyên tố tạo thành.
♦ Đáp án A: tổng số e: 24+8.4+2=58 → loại
♦ Đáp án B: tổng số e: 16.2+8.3+2=58 → Loại
♦ Đáp án C: loại do có 3 chất tạo thành
♦ Đáp án D: tổng số e: 16+8.4+2=50 → thỏa mãn
Đáp án D

Hợp chất M được tạo thành từ cation X+ và anion Y 2-, Mỗi ion đều do 5 nguyên tử của hai nguyên tố tạo nên. Tổng số proton trong X+ là 11 và tổng số electron trong Y 2- là 50.
Hai nguyên tố trong Y 2- thuộc cùng một phân nhóm và thuộc hai chu kỳ liên tiếp.
Hãy xác định công thức phân tử và gọi tên M.
Giải: Gọi X là số proton trung bình của hai nguyên tố tạo nên X+, ta có X = 11/5 = 2,2. Trong hai nguyên tố tạo nên X+ phải có H hoặc He. Nhưng He là khí trơ nên bị loại.
Gọi R là nguyên tố thứ hai tạo ra X+, khi đó X+ là RnHm+ .
Theo thành phần cấu tạo của X+ ta có: suy ra: n( ZR – 1) = 6
Chỉ có n =1, ZR = 7 ( R là N ) là phù hợp. Cation X+ là NH4+.
Gọi Y là số electron trung bình trong các nguyên tử của anion Y2-.
Ta có:Y = (50 – 2)/5 = 9,6.Trong Y2- có một nguyên tố có z < 9,6 , thuộc chu kỳ 2 và nguyên tố còn lại thuộc chu kỳ 3. Vì đều thuộc chu kỳ nhỏ nên hai nguyên tố cách nhau 8 ô. Công thức Y2- là AxBy2-với: Chỉ có x =1; y=4; Z = 8 là phù hợp.A là S còn B là O.
Anion Y2- là SO42-. Vậy M là (NH4)2SO4 ( amoni sunfat).

Đáp án B
Ta có ![]()
Phải có một phi kim có ![]()
Do đó nguyên tố này chỉ có thể là H
Hai phi kim còn lại thuộc cùng 1 chu kì và thuộc 2 phân nhóm chính liên tiếp.
Gọi số proton của 2 nguyên tố đó lần lượt là Z và Z + 1
TH1: A có 2 nguyên tử H
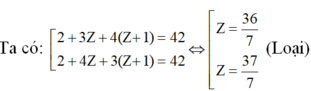
TH2: A có 3 nguyên tử H:
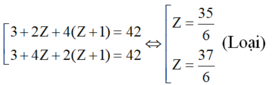
TH3: A có 4 nguyên tử H:
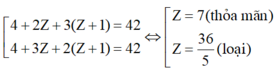
⇒ Hai nguyên tố còn lại là N (Z = 7) và O (Z = 8)
⇒ Công thức phân tử của A là: N2H4O3 hay NH4NO3
Nhận xét các đáp án:
A đúng: phân tử khối của A là 80 chia hết cho 5.
B sai: Trong phân tử A chứa liên kết ion liên kết cộng hóa trị và liên kết cho nhận
C đúng: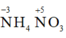 nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D đúng: 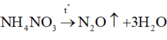

Đáp án B
Ta có  => Phải có một phi kim có Z
≤
4
=> Phải có một phi kim có Z
≤
4
Do đó nguyên tố này chỉ có thể là H
Hai phi kim còn lại thuộc cùng 1 chu kì và thuộc 2 phân nhóm chính liên tiếp.
Gọi số proton của 2 nguyên tố đó lần lượt là Z và Z + 1
TH1: A có 2 nguyên tử H
Ta có:
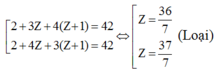
TH2: A có 3 nguyên tử H:
Ta có:
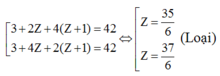
TH3: A có 4 nguyên tử H:
Ta có:
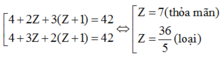
Hai nguyên tố còn lại là N (Z = 7) và O (Z = 8)
Công thức phân tử của A là: N2H4O3 hay NH4NO3
Nhận xét các đáp án:
A đúng: phân tử khối của A là 80 chia hết cho 5.
B sai: Trong phân tử A chứa liên kết ion liên kết cộng hóa trị và liên kết cho nhận
C đúng: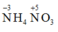 nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
nên trong các phản ứng hóa học A vừa thể hiện tính khử vừa thể hiện tính oxi hóa
D đúng: 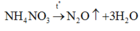

+) Đối với ion M+: Tổng số electron là 10
\(\Rightarrow\) Chắc chắn có H và H+ cấu tạo từ 5 nguyên tử
\(\Rightarrow\) \(NH_4^+\) là phù hợp nhất
+) Đối với ion X3-: Gồm 2 phi kim thuộc 2 chu kỳ liên tiếp cách nhau 7 electron
\(\Rightarrow\left[{}\begin{matrix}OvàP\\FvàS\end{matrix}\right.\) \(\Rightarrow X^{3-}\) cấu tạo từ 5 nguyên tử
\(\Rightarrow PO_4^{3-}\) phù hợp
\(\Rightarrow\) T là \(\left(NH_4\right)_3PO_4\)