Cân bằng p.ứng cháy. Giúp mình vs ạ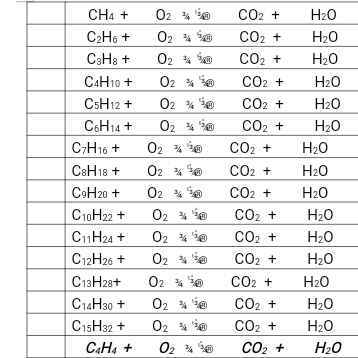
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


8. Cu(OH)2+H2SO4=>CuSO4+2H2O
9, FeO+2HCl2=>FeCl2+H2O
10, Fe2O3+3H2SO4=>Fe2(SO4)3+3H2O
11, Cu(NO3)2+2NaOH=>Cu(OH)2+2NaNO3

Tham Khảo: :v
Điều kiện phản ứng
- Điều kiện bình thường.
- Tốc độ phản ứng xảy ra nhanh hơn ở nhiệt độ cao.
Cách thực hiện phản ứng
- Cho Al phản ứng với dung dịch axit HCl tạo muối nhôm clorua và có khí H2 bay ra.
Hiện tượng nhận biết phản ứng
- Phản ứng hoà tan chất rắn nhôm Al và sủi bọt khí không màu.
Bạn có biết
Tương tự Al, các kim loại khác đứng trước Hiđro trong dãy điện hoá có phản ứng với dung dịch axit HCl tạo muối clorua và có khí H2 bay ra.

\(a.2KClO_3\underrightarrow{t^o}2KCl+3O_2\uparrow\\ b.2Mg+O_2\underrightarrow{t^o}2MgO\)
a) phản úng phân huỷ
b) phản ứng hoá hợp

a) S + O2 --to--> SO2
b) \(n_S=\dfrac{9,6}{32}=0,3\left(mol\right)\)
\(n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: S + O2 --to--> SO2
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,15}{1}\) => S dư, O2 hết
c)
PTHH: S + O2 --to--> SO2
________0,15----->0,15
=> mSO2 = 0,15.64 = 9,6(g)

Bài làm
a) Zn + 2HCl -----> ZnCl2 + H2
b) nZn = \(\frac{13}{65}=\)0,2 ( mol )
Theo phương trình: nH2 = nZn = 0,2 mol.
=> VH2 = 0,2 . 22,4 = 4,48 ( l )
~ Mik nghĩ bn nên đăng lên h để nhận được câu trả lời nhanh và chất lượng hơn của mik ~

a/ \(2Cu+O_2\rightarrow^{t^0}2CuO\)
b/ \(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
c/ \(2KMnO_4\rightarrow^{t^0}K_2MnO_4+MnO_2+O_2\uparrow\)
d/ \(3H_2+Fe_2O_3\rightarrow^{t^0}2Fe+3H_2O\)
e/ \(2KClO_3\rightarrow^{t^0}2KCl+3O_2\uparrow\)
f/ \(4H_2+Fe_3O_4\rightarrow^{t^0}3Fe+4H_2O\)
g/ \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
h/ \(2Mg+O_2\rightarrow^{t^0}2MgO\)

\(O_2+S\rightarrow SO_2\)
\(11O_2+4FeS_2\xrightarrow[]{t^o}8SO_2+2Fe_2O_3\)



