Câu 1. Trong tự nhiên brom có hai đồng vị, đồng vị 79Br chiếm 54% số nguyên tử và nguyên tử khối trung bình của brom là 79,92. Xem nguyên tử khối có giá trị bằng số khối thì đồng vị thứ hai có số khối là
A. 82. B. 83.
C. 80. D. 81.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
%41K = 100 - 93,26 - 0,012 = 6,728%.
Khối lượng nguyên tử trung bình của K là:
MK = 39 x 0,9326 + 40 x 0,00012 + 41 x 0,06728 = 39,13468.
Khối lượng nguyên tử trung bình của Br là:
MBr = 79,92.
Thành phần phần trăm của 39K trong KBr là
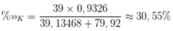

Nguyên tử khối của Brom là :
\(\overline{A}=\frac{79.50,69+81.49,31}{100}\approx79,98u\)
Vậy Nguyên tử khối trung bình của Brom là \(79,98u\)
Nguyên tử khối trung bình của Br là:
\(\overline{A}=\frac{79.50,69+81.49,31}{50,69+49,31}=\frac{7998,62}{100}=79,9862\)
Vậy nguyên tử khối trung bình của Br là 79,9862

\(a.Đặt:\%^{79}Br=a\left(a>0\right)\\ \Rightarrow \%^{81}Br=100\%-a\\ \overline{NTK}_{Br}=79,91\\ \Leftrightarrow79a+81.\left(100\%-a\right)=79,91\\ \Leftrightarrow a=54,5\%\\ \Rightarrow\%^{79}Br=54,5\%;\%^{81}Br=45,5\%\)
b. Phần trăm theo KL đồng vị 79Br trong phân tử CaBr2:
\(54,5\%.\dfrac{70.91.2}{79,91.2+40}\approx43,59\%\)
c.
\(\left\{{}\begin{matrix}P=E\\P+N=79\\\left(P+E\right)-N=26\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P+N=79\\2P-N=26\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}P=E=Z=35\\N=44\end{matrix}\right.\)

Nguyên tử khối trung bình:
\(\overline{A}=\dfrac{50,7\cdot79+49,3\cdot81}{100}=79,986\approx80\)
Phần trăm số nguyên tử đồng vị còn lại là 100% -54% = 46%
Gọi A là số khối đồng vị còn lại
Ta có :
$A.46\% + 79.54\% = 79,92 \Rightarrow A = 81$
Đáp án D