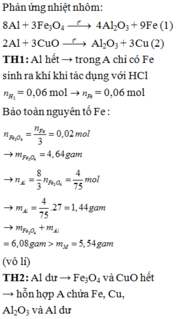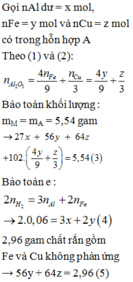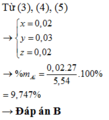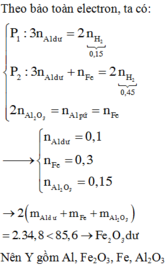hòa tan 11g Al và Fe trong dung dịch NaOH dư thấy còn lại a gam chất rắn X ko tan . Hòa tan a gam chất rắn X vào dung dịch HCl dư thu đc 2,24 l khí H2 (ĐKTC) . tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Al + 2NaOH + 2H2O \(\rightarrow\) 2NaAlO2 + 3H2
CR X là Fe
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,1 <----------------------- 0,1
%mFe = 50,91%
%mAl = 49,09%
cho mình bk lí do vì sao mà Al lại + với NaOH và H2O đc ko H2O ở đâu ra vậy bạn

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ BT : e 0 , 2 . 3 + 2 . ( 0 , 2 - 0 , 1 ) = 0 , 2 x . 2 + 0 , 2 y (2). Từ (1), (2) suy ra: x = 1,5

Chọn C.
Hỗn hợp X gồm Al và Fe với số mol mỗi chất bằng 0,2 mol
Hỗn hợp Y gồm Cu(NO3)2 (0,2x mol) và AgNO3 (0,2y mol)
Hỗn hợp Z gồm Ag, Cu và Fe dư Þ nFe dư = 0,1 mol và 64.0,2x + 108.0,2y = 40,8 (1)
→ B T : e 0 , 2 . 3 + 2 . 0 , 2 - 0 , 1 = 0 , 2 x . 2 + 0 , 2 y 2
Từ (1), (2) suy ra: x = 1,5

a) \(n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,05<-----------0,05---->0,075
=> \(\%Al=\dfrac{0,05.27}{14,15}.100\%=9,54\%\)
=> \(\%Cu=\dfrac{14,15-0,05.27}{14,15}.100\%=90,46\%\)
b) \(V_{H_2}=0,075.22,4=1,68\left(l\right)\)
c) \(n_{Cu}=\dfrac{14,15-0,05.27}{64}=0,2\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,05->0,0375
2Cu + O2 --to--> 2CuO
0,2-->0,1
=> \(V_{O_2}=\left(0,1+0,0375\right).22,4=3,08\left(l\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ m_{AlCl_3}=6,675\left(mol\right)\\ n_{AlCl_3}=\dfrac{6,675}{133,5}=0,05\left(mol\right)\\ \Rightarrow n_{Al}=n_{AlCl_3}=0,05\left(mol\right)\\ \Rightarrow m_A=0,05.27=1,35\left(g\right);m_{Cu}=14,15-1,35=12,8\left(g\right)\\ \%m_{Cu}=\dfrac{12,8}{14,15}.100\approx90,459\%\\ \Rightarrow\%m_{Al}\approx9,541\%\\ b,n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\\ n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.0,05=0,075\left(mol\right)\\ \Rightarrow V=V_{H_2\left(đktc\right)}=0,075.22,4=1,68\left(l\right)\\ 4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\\ 2Cu+O_2\rightarrow\left(t^o\right)2CuO\\ n_{O_2}=\dfrac{3}{4}.n_{Al}+\dfrac{1}{2}.n_{Cu}=\dfrac{3}{4}.0,05+\dfrac{1}{2}.0,2=0,0875\left(mol\right)\)
\(\Rightarrow V_{O_2\left(đktc\right)}=0,0875.22,4=1,96\left(l\right)\)

Khi cho hỗn hợp Al, Fe, Zn vào dung dịch NaOH dư thì chỉ có Zn và Al tham gia phản ứng tạo H2(0,225 mol), phần chất rắn không tan là Fe
Cho Fe phản ứng với lượng dư HCl tạo ra 0,1 mol khí → nFe = nH2 = 0,1 mol → mAl + mZn= 16,7- 5,6 = 11,1
Gọi số mol của Al và Zn lần lượt là x, y
Ta có hệ 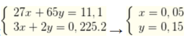
→ %Al = 0 , 05 . 27 16 , 7 ×100% = 8,08 %.
Đáp án D

Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)

Ta có: $n_{Al}=n_{Fe}=0,1(mol)$
Sau phản ứng thì Al hết, Fe chưa phản ứng hoặc còn dư
Gọi số mol $Cu(NO_3)_2 và $AgNO_3$ lần lượt là a;b
Ta có: $64a+108b=28$
Bảo toàn e toàn bộ quá trình ta có: $2a+b=0,4$
Giải hệ ta được $a=0,1;b=0,2$
$\Rightarrow [Cu(NO_3)_2]=1M;[AgNO_3]=2M$
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0.05\left(mol\right)\)
\(n_{Al}=n_{Fe}=a\left(mol\right)\)
\(\Rightarrow a=\dfrac{8.3}{27+56}=0.1\)
\(n_{AgNO_3}=x\left(mol\right),n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\)
\(m_{cr}=108x+64y=28\left(1\right)\)
Bảo toàn e :
\(x+2y=0.4\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
\(C_{M_{AgNO_3}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0.1}{0.1}=1\left(M\right)\)