A, B là hai kim loại nằm ở hai chu kỳ liên tiếp thuộc nhóm IIA . Cho 4,4g hỗn hợp A và B tác dụng với dung dịch HCl 1M (dư) thu được 3,36 lít khí (đktc).
- Viết các phương trình phản ứng và xác định tên 2 kim loại
- Tính thể tích HCl đã dùng , biết rằng HCl dùng dư 25% so với lượng cần thiết.


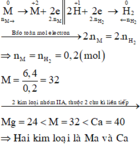

theo đề bài:
n\(_{H_2}=\)3,36/22,4=0,15mol
đặt A<M<B
PTPU:
M+2HCl->MCl2+H2
0,15...0,3.......0,15....0,15(mol)
n\(_M=0,15mol\)
=>M\(_M=\dfrac{4,4}{0,15}\approx29,3g\)
A<29,3<B
vì A và B là 2 kim loại liên tiếp trong bảng tuần hoàn
=>A là Mg, B là Ca
b)n\(_{HCl_{pư}}\)=0,3 mol
V\(_{HCl_{pư}}=0,3.22,4=6,72l\)
b, nHCl dư = 0,3 * 25% = 0,075 mol
n dùng = n pư + n dư = 0.3 + 0,075= 0,375 mol
V HCl = 0,375/1=0,375 l