bài 1 hòa tan 4g một kim loại M vào 96,2 g H2O đc dd bâz có nồng độ 7,4% và V lít (đkc) Mlà kim loại loại
bài 2 Hòa tan hoàn toàn hh X gồm Fèva Mg = 1 lượng vừa đủ dd HCl 20% thu được dd Y trong đó nồng độ FeCl=15,76%.nồng độ % của MgCl2 trong dd là
11,79%
12,79%
13,79%
10,79%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

R2O3+6HCl->2RCl3+3H2O
nHCl=0.3(mol)
->nR=0.05(mol)->MR2O3=8:0.05=160(g/mol)
->MR=(160-16*3):2=56(g/mol)->M là Fe
Bài 2
nH2=0.3(mol)
2X+2nHCl->2XCln+nH2(n là hóa trị của kim loại)
nX=0.6:n
+) n=1->MX=9(g/mol)->loại
+)n=2->MX=18(g/mol)->loại
+)n=3->MX=27(g/mol)->X là Al
Bài cuối bạn viết phương trình,chỉ phương trình Al+H2SO4 mới tạo khí thôi,vậy bạn tính được khối lượng nhôm,từ đó tính ra khối lượng nhôm oxit nhé,vì đang vội nên mình không giải giúp bạn được
Bài 3
nH2 = \(\frac{13,44}{22,4}\) = 0,6 mol
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 \(\uparrow\) (1)
0,4 <---- 0,6 <-------- 0,2 <------ 0,6 (mol)
Al2O3 + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2O (2)
a) %mAl = \(\frac{0,4.27}{31,2}\) . 100% = 34,62%
%mAl2O3 = 65,38%
b) nAl2O3 = \(\frac{31,2-0,4.27}{102}\) = 0,2 (mol) = nAl2(SO4)3
Theo pt(2) nH2SO4 = 3nAl2O3 = 0,6 (mol)
m dd H2SO4 = \(\frac{\left(0,6+0,6\right)98}{20\%}\) = 588(g)
c) m dd spư = 31,2 + 588 - 0,6 . 2 = 618 (g)
C%(Al2(SO4)3) = \(\frac{\left(0,2+0,2\right)342}{618}\) . 100% = 22,14%

\(M+H_2SO_4\rightarrow MSO_4+H_2\uparrow\\ n_{ASO_4}=n_A=n_{H_2}=n_{H_2SO_4}=a\left(mol\right)\\ 1.m_{ddH_2SO_4}=\dfrac{98a.100}{20}=490a\left(g\right)\\ 2.m_{ddsau}=M_M.a+490a-2a=\left(M_M+488\right).a\left(g\right)\\ C\%_{ddsau}=22,64\%\\ \Leftrightarrow\dfrac{\left(M_M+96\right)a}{\left(M_M+488\right)a}.100\%=22,64\%\\ \Leftrightarrow M_M=18,72\left(loại\right)\)
Khả năng cao sai đề nhưng làm tốt a,b nha

- Kim loại Cu sẽ không tan trong dung dịch HCl ở đk thường. Nên nó sẽ là kim loại duy nhất trong hỗn hợp này tác dụng với dd H2SO4 đặc,nóng .
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2+H_2O\)
Ta có: \(n_{Cu}=n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
=> mCu= 0,1.64=6,4(g)
\(\rightarrow m_{hh\left(Mg,Al\right)}=11,5-6,4=5,1\left(g\right)\\ Đặt\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \rightarrow\left\{{}\begin{matrix}24a+27b=5,1\\a+1,5b=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\\ \left\{{}\begin{matrix}\%m_{Cu}=\dfrac{6,4}{11,5}.100\approx55,652\%\\\%m_{Mg}=\dfrac{24.0,1}{11,5}.100\approx20,87\%\\\%m_{Al}=\dfrac{27.0,1}{11,5}.100\approx23,478\%\end{matrix}\right.\)

\(n_{H2}=\dfrac{3,7175}{24,79}=0,15\left(mol\right)\)
Pt : \(R+2HCl\rightarrow RCl_2+H_2|\)
1 2 1 1
0,15 0,15
\(n_R=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(M_R=\dfrac{9,75}{0,15}=65\) (g/mol)
Vậy kim loại R là Kẽm
Chúc bạn học tốt

1/ nNaCl=5,85/58,5=0,1 mol.
nAgNO3=34/170=0,2 mol.
PTPU: NaCl+AgNO3=>AgCl+NaNO3
vì NaCl và AgNO3 phan ung theo ti le 1:1 (nAgNO3 p.u=nNaCl=0,1 mol)
=>AgNO3 du
nAgNO3 du= 0,2-0,1=0,1 mol.
Ta tinh luong san pham theo chat p.u het la NaCl
sau p.u co: AgNO3 du:0,1 mol; AgCl ket tua va NaCl: nAgCl=nNaNO3=nNaCl=0,1 mol.V(dd)=300+200=500ml=0,5 ()l
=>khoi lg ket tua: mAgCl=0,1.143,5=14,35 g
C(M)AgNO3=C(M)NaNO3=n/V=0,1/0,5=0,2 M

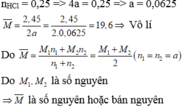
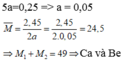

Bài 1:
2M + 2nH2O → 2M(OH)n + nH2
4/M____4n/M______4/M________(mol)
Ta có (4+ 68n/M)/(4+ 68n/M + 96,2- 72n/M) = 7,4%
=> M= 20n (g/mol).
Ta nhận thấy chỉ có n= 2 thỏa mãn.
=> M là Ca.
Bài 2:
Fe + 2HCl → FeCl2
_x____2x______x___(mol)
Mg + 2HCl → MgCl2
_y____2y______y___(mol)
Ta có (73x+ 73y)/(73x + 73y + m_H2O)= 0,2 ∩ 127x/(127x + m_H2O) = 0,1576
=> y/x ≈ 1,325.
C%_MgCl2 = 95y/(95y+ m_H2O) ≈ 15,64% (???).