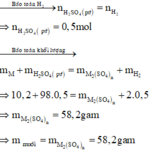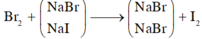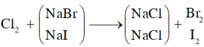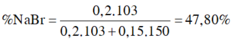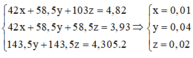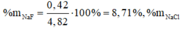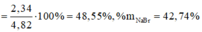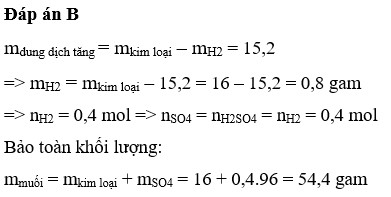Cho axít sunfuric loãng dư phản ứng với 18,4 gam hỗn hợp canxi cacbonat và magiê Cacbonat sau phản ứng cô cạn dung dịch thu được 25,6 gam hỗn hợp muối khan tính khối lượng mỗi muối trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
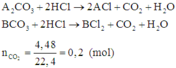
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)

Đáp án B
Áp dụng định luật bảo toàn khối lượng ta có:
m C O 2 = 18 , 4 - 9 , 6 = 8 , 8 g a m ⇒ n C O 2 = 0 , 2
Ta có n N a O H n C O 2 = 1 , 5 ⇒ Sau phản ứng ta thu được 2 muối có số mol bằng nhau và bằng 0,1 mol
⇒ m = 0,1. 106 + 0,1 .84 = 19 gam

Đáp án A
Gọi M là kim loại chung cho Zn và Mg với hóa trị n
Sơ đồ phản ứng: M + H 2 SO 4 ( loãng , dư ) → M 2 ( SO 4 ) n ⏟ muối + H 2 ↑
Khí thu được là
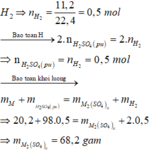

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l