Cho 18,4 gam hỗn hợp Fe và kim loại A(hóa trị II) phản ứng với dung dịch HCl dư thu được 2,24 lít khí \(H_2\) (ở đktc) và m gam bột không tan trong dung dịch sau phản ứng. Lọc lấy bột không tan đem tác dụng hết với 2,24 lít Oxi(ở đktc) thu được 1 Ôxit màu đen . Tính khối lượng các chất trong hỗn hợp ban đầu và xác định A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
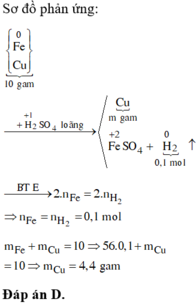
nFe = nH2 = 0,1 mol
Chất rắn không tan là Cu
=> m = 10 – mFe = 10 – 0,1 . 56 = 4,4g

Đáp án : C
, nH2 = nZn = 0,2 mol
=> mkhông tan = mCu = mhỗn hợp đầu – mZn = 3,4g

Phương trình hóa học của phản ứng:
Cu + H 2 SO 4 → Không phản ứng
Fe + H 2 SO 4 → FeSO 4 + H 2
n H 2 = 2,24/22,4 = 0,1 mol
n Fe = 0,1 x 56 = 5,6g. Khối lượng Cu không hòa tan là
m = 10 - 5,6 = 4,4g

Chọn A.
Ta có: n(H2) = 0,2 → n(Zn) = 0,2 → m(Zn) = 13 (g) → m(Cu) = 2 (g) → m = 2 (g)

Đáp án C
Zn phản ứng vơi HCl tạo H2, kim loại không tan là Cu.
n(H2) = 0,2 mol suy ra n(Zn) =0,2 mol
Nên m(Zn) = 13g
Suy ra m(Cu) = 15- 13= 2g

Đáp án D
Định hướng tư duy giải
m = 19,4 – 0,2.65 =6,4 gam

Fe+2HCl\(\rightarrow\)FeCl2+H2
A không phản ứng với HCl
\(n_{Fe}=n_{H_2}=\dfrac{2,24}{22,4}=0,1mol\)
mFe=5,6g\(\rightarrow\)mA=18,4-5,6=12,8g
2A+O2\(\rightarrow\)2AO
\(n_A=2n_{O_2}=2.\dfrac{2,24}{22,4}=0,2mol\)
\(M_A=\dfrac{m}{n}=\dfrac{12,8}{0,2}=64\left(Cu\right)\)