đốt cháy hoàn toàn hỗn hợp X gồm CH4 và C2H4 thư được khí CO2 và hơi nước theo tỉ lệ thể tích là 5:8. Đem đốt hoàn toàn 7,6gam hỗn hợp X rồi hấp thụ toàn bộ lượng sản phẩm thu được vào dung dịch chứa 29,6g Ca(OH)2. Sau khi hấp thụ, khối lượng dung dịch tăng hay giảm bao nhiêu gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
Theo định luật bảo toàn khối lượng ta có:
mEste? + mNaOH? = mMuối✓ + mAncol✓
Khi đốt muối của axit no đơn chức mạch hở ta có phản ứng:
2CnH2n–1O2Na + (3n–2)O2 → t o Na2CO3 + (2n–1)CO2 + (2n–1) H2O.
⇒ nCO2 = nH2O Û mDung dịch giảm = mCaCO3 – mCO2 – mH2O.
Đặt nCO2 = nH2O = a ⇒ 100a – 44a – 18a = 3,42 Û a = 0,09 mol.
+ Từ phản ứng đốt muối ta có tỷ lệ:
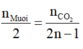 .
.
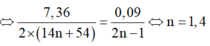
⇒ nMuối = 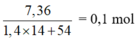 = nNaOH pứ
= nNaOH pứ
⇒ nNaOH pứ = 4 gam ✓.
+ Bảo toàn
khối lượng ⇒ mEste = 7,36 + 3,76 – 4 = 7,12 gam

Đáp án C
Theo định luật bảo toàn khối lượng ta có:
mEste? + mNaOH? = mMuối✓ + mAncol✓
Khi đốt muối của axit no đơn chức mạch hở ta có phản ứng:
2CnH2n–1O2Na + (3n–2)O2 → t o Na2CO3 + (2n–1)CO2 + (2n–1) H2O.
⇒ nCO2 = nH2O Û mDung dịch giảm = mCaCO3 – mCO2 – mH2O.
Đặt nCO2 = nH2O = a ⇒ 100a – 44a – 18a = 3,42 Û a = 0,09 mol.
+ Từ phản ứng đốt muối ta có tỷ lệ:
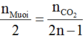 .
.
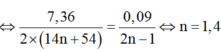
⇒ nMuối = 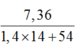
= 0,1 mol = nNaOH pứ ⇒ nNaOH pứ = 4 gam ✓.
+ Bảo toàn
khối lượng ⇒ mEste = 7,36 + 3,76 – 4 = 7,12 gam

a) Khí còn lại là CH4
\(n_{CH_4} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{C_2H_4} = \dfrac{8-0,15.16}{28} = 0,2(mol)\)
Vậy :
\(\%m_{CH_4} = \dfrac{0,15.16}{8}.100\% = 30\%\\ \%m_{C_2H_4} = 100\% - 30\% = 70\%\)
b)
\(CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 2O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CaCO_3} = n_{CO_2} = n_{CH_4} + 2n_{C_2H_4} =0,55(mol)\\ m_{CaCO_3} =0,55.100 = 55(gam) \)

Đáp án C
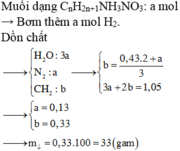
Gọi công thức chung của muối là: CnH2n+1COONa
Ta thấy đốt muối thì nCO2=nH2O
Đặt nCO2=nH2O=x=>nCaCO3=x
mdd giảm=mCaCO3-(mCO2+mH2O)
=>100x-(44x+18x)=3,42
=>x=0,09 mol
=>0,09(14n+68)=7,36(n+0,5)=>n=0,4
=>n muối=7,36(14.0,4+68)=0,1 mol
BTKL: m=m muối + m ancol – mNaOH
=7,36+3,76-0,1.40=7,12 gam

Giả sử: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
⇒ 16x + 28y = 7,6 (1)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ thể tích cũng là tỉ lệ số mol.
Ta có: \(\dfrac{V_{CH_4}}{V_{C_2H_4}}=\dfrac{5}{8}\Rightarrow\dfrac{n_{CH_4}}{n_{C_2H_4}}=\dfrac{x}{y}=\dfrac{5}{8}\)
\(\Rightarrow x=\dfrac{5}{8}y\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,125\left(mol\right)=n_{CH_4}\\y=0,2\left(mol\right)=n_{C_2H_4}\end{matrix}\right.\)
BTNT C và H, có: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CH_4}+2n_{C_2H_4}=0,525\left(mol\right)\\n_{H_2O}=\dfrac{4n_{CH_4}+4n_{C_2H_4}}{2}=0,65\left(mol\right)\end{matrix}\right.\)
Ta có: \(n_{OH^-}=2n_{Ca\left(OH\right)_2}=0,8\left(mol\right)\)
\(\Rightarrow\dfrac{n_{OH^-}}{n_{CO_2}}=\dfrac{0,8}{0,525}\approx1,5\)
⇒ Pư tạo CaCO3 và Ca(HCO3)2.
Giả sử: \(\left\{{}\begin{matrix}n_{CaCO_3}=a\left(mol\right)\\n_{Ca\left(HCO_3\right)_2}=b\left(mol\right)\end{matrix}\right.\)
BTNT Ca và C, có: \(\left\{{}\begin{matrix}a+b=0,525\\a+2b=0,8\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,25\left(mol\right)\\b=0,275\left(mol\right)\end{matrix}\right.\)
Có: m thêm vào dd = mCO2 + mH2O = 34,8 (gam)
Mà: m↓ = mCaCO3 = 0,25.100 = 25 (g)
Vậy: Dung dịch thu được tăng và tăng: 34,8 - 25 = 9,8 (g)
Bạn tham khảo nhé!

Đáp án C
Crackinh 0,1 mol C4H10 thu được hhX gồm CH4, C2H6, C2H4, C3H6 và C4H10.
Đốt cháy hoàn toàn hhX cũng chính là đốt cháy 0,1 mol C4H10
→ nCO2 = 0,1 x 4 = 0,4 mol; nH2O = 0,1 x 5 = 0,5 mol.
Khi hấp thụ 0,4 mol CO2 và 0,5 mol H2O vào dd nước vôi trong dư
→ nCaCO3 = 0,4 mol.
Sau phản ứng mdd giảm = mCaCO3 - mCO2 - mH2O
= 0,4 x 100 - 0,4 x 44 - 0,5 x 18 = 13,4 gam

Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\left(1\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_{3\downarrow}+H_2O\)
Theo PT: \(n_{CaCO_3}=n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{10}{100}=0,1\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,05\left(mol\right)\\n_{C_2H_2}=0,025\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}V_{CH_4}=0,05.22,4=1,12\left(l\right)\\V_{C_2H_2}=0,025.22,4=0,56\left(l\right)\end{matrix}\right.\)
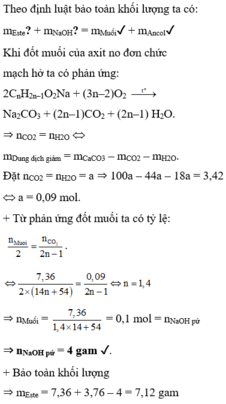
CH4+2O2→CO2+2H2O
C2H4+3O2→2CO2+2H2O
-Gọi số mol CH4 là x, số mol C2H4 là y
- Số mol CO2=x+2y
- Số mol H2O=2x+2y
- Theo đề ta có: (x+2y)/(2x+2y)=5/8→8x+16y=10x+10y→2x=6y→x=3y
16x+28y=7,6
Giải ra x=0,3, y=0,1
nCO2=x+2y=0,5mol
nH2O=2x+2y=0,8mol
nCa(OH)2=29,6/74=0,4mol
1<\(1< \dfrac{n_{CO_2}}{n_{Ca\left(OH\right)_2}}=\dfrac{0,5}{0,4}=1,25< 2\)
CO2+Ca(OH)2→CaCO3↓+H2O
2CO2+Ca(OH)2→Ca(HCO3)2
Gọi số mol CaCO3 là a, số mol Ca(HCO3)2. Ta có hệ:
a+b=0,4
a+2b=0,5
giải ra a=0,3, b=0,1
- Độ tăng=mCO2+mH2O−mCaCO3=0,5.44+0,8.18−0,3.100=6,4g