Cho m gam hỗn hợp gồm 2 kim loại Mg và Fe PƯ vừa đủ với dd chứa 10,95 gam axit clohidric HCl .Sau PƯ thu đc hh 2 muối và 3,36 lít hidro ở đktc
a, Tính giá trị m
b, Tính khối lượng hỗn hợp muối
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 2 : Đề bài ko cho klg của hh nên làm đại thế này !
Theo đề bài ta có :
\(\left\{{}\begin{matrix}nZn=\dfrac{16,9}{65}=0,26\left(mol\right)\\nH2=\dfrac{4,48}{22,4}=0,2\left(mol\right)\end{matrix}\right.\)
a) Ta có PTHH :
(1) \(Zn+2HCl->ZnCl2+H2\uparrow\)
(2) \(Zn+H2SO4->ZnSO4+H2\uparrow\)
Theo 2PTHH ta có :
1 mol Zn thì tạo ra 1 mol khí H2
Mà nZn(ban đầu) = 0,26 (mol ) nH2(ban đầu) = 0,2 (mol)
Ta có :
\(nZn=\dfrac{0,26}{1}mol>nH2=\dfrac{0,2}{1}mol\)
=> nZn dư
b) Vì nHCl = nH2SO4 nên => nH2 ở 2PTHH là bằng nhau
Theo 2 PTHH ta có :
nZnCl2= nZnSO4 = nH2 = 0,2 (mol)
=> m(tổng 2 muối) = mZnCl2 + mZnSO4 = 0,2.135 + 0,2.160 = 59(g)
Vậy.............
2, goi x la so mol cua H2 pt (1)
y la so mol cua H2 pt (2)
\(n_{Zn}=\dfrac{16,9}{65}=0,26\left(mol\right)\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo pt ta thấy: nZn = nH2
nhưng theo đề thì nZn > nH2
a, => Zn dư
Zn + 2HCl \(\rightarrow\) ZnCl2 + H2 (1)
de: 2x \(\leftarrow\) x \(\leftarrow\) x Zn + H2SO4 \(\rightarrow\) ZnSO4 + H2 (2)
de: y \(\leftarrow\) y \(\leftarrow\) y
b, Ta co: 2x = y ; x + y = 0,2
=> x = 1/15 ; y = 2/15
\(m_{ZnCl_2}=\dfrac{1}{15}.136\approx9,067g\)
\(m_{ZnSO_4}=\dfrac{2}{15}.161\approx21,467g\)

PTHH
Mg + 2HCl ----> MgCl2 + H2 (1)
MgO + 2HCl -----> MgCl2 + H2O (2)
a) Theo pt(1) n Mg = n H2 = \(\frac{1,12}{22,4}\) = 0,05 (mol)
==> m Mg = 0,005 . 24=1,2 (g)
%m Mg = \(\frac{1,2}{3,2}\). 100%= 37,5%
%m MgO= 100% - 37,5%= 62,5%
b)m dd sau pư = 3,2 + 246,9 - 0,05 . 2=250 (g)
Theo pt(1)(2) n MgCl2(1) = n Mg = 0,05 mol
n MgCl2 (2) = n MgO=\(\frac{3,2-1,2}{40}\)=0,05(mol)
==> tổng n MgCl2 = 0,1 (mol) ---->m MgCl2 = 9,5 (g)
C%(MgCl2)= \(\frac{9,5}{250}\) .100% = 3,8%

Câu 1
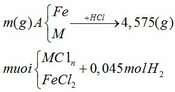
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
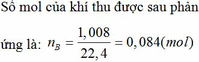
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
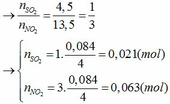
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
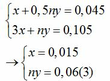
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

Gọi nZn = a (mol); nMg = b (mol)
PTHH:
Zn + H2SO4 -> ZnSO4 + H2
a ---> a ---> a ---> a
Mg + H2SO4 -> MgSO4 + H2
b ---> b ---> b ---> b
nH2 = 17,92/22,4 = 0,8 (mol)
=> a + b = 0,8 (1)
=> 136a + 95b = 110,35 (2)
Từ (1)(2) => nghiệm âm:v
Bạn xem lại đề giúp mình nha giải không đc
INFINITE SOL