1.Hòa tan hết 10,4g hỗn hợp gồm 1 kim loại hóa trị II và oxit của nó vào dd HCl dư thu được 2,24 lít khí H2(đktc).Cô cạn dd sau phản ứng thu được 28,5 g muối khan a)Xác định kim loại và oxit của phi kim đó (Mg MgO) b)Tính % khối lượng các chất trong hỗn hợp ban đầu (23,07% 76,93%)
2.để hòa tan 16g hh 1 kim loại hóa tri II và 1 kim loại hóa trị III dùng 680ml dd HCl 2M a)cô cạn dd thu được ? g muối khan (64,28g) b) Tính V H2 thoát ra từ thí nghiệm trên (15.232 lít) c)Nếu biết kim loại hóa trị III trên là Al và nAl=5n kim loại hóa trị II,hãy xác định kim loại hóa trị II (Zn)

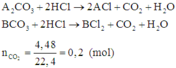
Bài 2:
a, Ta có gọi kim loại hóa tri II là R
gọi kim loại hóa trị III là M
nHCl = 0,68 . 2 = 1,36 ( mol )
=> mHCl = 1,36 . 36,5 = 49,64 ( gam )
R + 2HCl \(\rightarrow\) RCl2 + H2
x......2x..........x.............x
2M + 6HCl \(\rightarrow\) 2MCl3 + 3H2
y..........3y............y............1,5y
Ta có 2x + 3y = 1,36
=> x + 1,5y = 0,68
=> mmuối khan + mH2 = mHCl + mhỗn hợp kim loại
=> mmuối khan + mH2 = 49,64 + 16 = 65,64 ( gam )
=> mmuối khan + 2 . 0,68 = 65,64
=> mmuối khan = 64,28 ( gam )
b, VH2 = 0,68 . 22,4 = 15,232 ( lít )
c, Ta có M là Al
R + 2HCl \(\rightarrow\) RCl2 + H2
x......2x..........x.............x
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
y..........3y............y............1,5y
Và ta có nAl = 5nR
=> y = 5x
mà x + 1,5y = 0,68
=> x + 1,5 . 5x = 0,68
=> x = 0,08 ( mol )
=> y = 0,4 ( mol )
=> mAl = 27 . 0,4 = 10,8 ( gam )
=> 0,08 = \(\dfrac{16-10,8}{M_R}\)
=> MR = 65
=> R là Zn
\(n_{H_2}=0,1\left(mol\right)\)
\(M+2HCl--->MCl_2+H_2\uparrow\)
0,1..............................0,1...............0,1
\(MO+2HCl-->MCl_2+H_2O\)
x.....................................x
\(m_{muôi}=0,1\left(M+71\right)+x\left(M+71\right)=28,5\)
\(\Leftrightarrow\left(M+71\right)\left(0,1+x\right)=28,5\)
\(\Rightarrow M=\dfrac{28,5}{0,1+x}-71\left(1\right)\)
\(m_{hh}=0,1M+x\left(M+16\right)=10,4\left(2\right)\)
Thay (1) vào(2)
\(\Rightarrow x=0,2\)
M=24
=>M : Mg
vậy kim loại và oxit kim loại cần tìm là Mg và MgO
b) \(\%Mg=\dfrac{0,1.24}{10,4}.100\%=23,07\%\)
\(\%MgO=100\%-23,07\%=76,93\%\)