3. Cho 6,5 gam Zn vào dd HCl lấy dư, sau phản ứng thu được chất khí. Tính thể tích khí thoát ra ở đktc, biết H% = 90%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
a. PTHH: Zn + H2SO4 ---> ZnSO4 + H2
b. Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\)
=> \(V_{H_2}=0,1.22,4=2,24\left(lít\right)\)
c. Theo PT: \(n_{H_2SO_4}=n_{Zn}=0,1\left(mol\right)\)
=> \(m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
Ta có: \(C_{M_{H_2SO_4}}=\dfrac{9,8}{m_{dd_{H_2SO_4}}}.100\%=25\%\)
=> \(m_{dd_{H_2SO_4}}=39,2\left(g\right)\)
Ta có: \(m_{H_2}=0,1.2=0,2\left(g\right)\)
=> \(m_{dd_{ZnSO_4}}=6,5+39,2-0,2=45,5\left(g\right)\)
Theo PT: \(n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\)
=> \(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
=> \(C_{\%_{ZnSO_4}}=\dfrac{16,1}{45,5}.100\%=35,4\%\)

\(n_{Zn}=\dfrac{1,625}{65}=0,025mol\)
\(n_{HCl}=\dfrac{3,65}{36,5}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,025 < 0,1 ( mol )
0,025 0,05 0,025 0,025 ( mol )
\(V_{H_2}=0,025.22,4=0,56l\)
Chất dư là HCl
\(m_{HCl\left(dư\right)}=\left(0,1-0,05\right).36,5=1,825g\)
\(m_{ZnCl_2}=0,025.136=3,4g\)
huhu cảm ơn bạn đề dài quá nên đưa lên đây làm giúp

1. Chất nào sau đây không phản ứng với dung dịch HCl
A. Fe. B. Fe2O3. C. SO2. D. Mg(OH).
2. Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn=65)
A. 1,12 lít. B. 2,24 lít. C. 3,36 lít. D. 22,4 lít.

nFe=0,2(mol)
mHCl=29,2(g) => nHCl=0,8(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
Ta có: 0,2/1 < 0,8/2
=> HCl dư, Fe hết, tính theo nFe
=> nFeCl2=nH2=nFe=0,2(mol) =>mFeCl2= 25,4(g)
=>V(H2,đktc)=0,2.22,4=4,48(l)
nHCl(p.ứ)=2.0,2=0,4(mol) => nHCl(dư)=0,4(mol)
=>mHCl(dư)=0,4.36,5=14,6(g)
mddsau= mddHCl + mFe- mH2=11,2+400-0,2.2=410,8(g)
=>C%ddHCl(dư)=(14,6/410,8).100=3,554%
C%ddFeCl2= (25,4/410,8).100=6,183%

\(a)n_{Fe}=\dfrac{5,6}{56}=0,1mol\\ n_{Mg}=\dfrac{4,8}{24}=0,2mol\\ Fe+2HCl\rightarrow FeCl_2+H_2\)
0,1 0,2 0,1 0,1
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(V_{H_2}=\left(0,1+0,2\right).22,4=6,72l\\ b)V_{ddHCl}=\dfrac{0,2+0,4}{2}=0,3l\\ c)m_{muối}=0,1.127+95.0,2=31,7g\)

a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{HCl}=100.14,6\%=14,6\left(g\right)\Rightarrow n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\) ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, \(\left\{{}\begin{matrix}n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\\n_{HCl\left(pư\right)}=2n_{Zn}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,4-0,2=0,2\left(mol\right)\)
Ta có: m dd sau pư = 6,5 + 100 - 0,1.2 = 106,3 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{106,3}.100\%\approx12,79\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,2.36,5}{106,3}.100\%\approx6,87\%\end{matrix}\right.\)
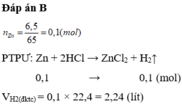

$n_{Zn} = \dfrac{6,5}{65} = 0,1(mol)$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{H_2} = n_{Zn\ pư} = 0,1.90\% = 0,09(mol)$
$V_{H_2} = 0,09.22,4 = 2,016(lít)$