Cho 6g hỗn hợp Mg và MgO tác dụng dung dịch HCL 20% ( D=1,12g/ml). Phản ứng xong thu được 2,24 lít khí ( đo đktc). Tính :
1/ % khối lượng từng chất có trong hỗn hợp.
2/ Thể tích dung dịch HCL 20% đem dùng.
3/ Tính C% dung dịch muối thu được.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH :
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
0,09 0,18 0,09 0,09
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(a,\%m_{Mg}=\dfrac{0,1.24}{6}=40\%\)
\(\%m_{MgO}=100\%-40\%=60\%\)
\(n_{MgO}=\dfrac{6-2,4}{40}=0,09\left(mol\right)\)
\(b,m_{HCl}=\left(0,2+0,18\right).36,5=13,87\left(g\right)\)
\(m_{ddHCl}=\dfrac{13,87.100}{20}=69,35\left(g\right)\)
\(V_{ddHCl}=\dfrac{m}{D}=\dfrac{69,35}{1,1}\approx63\left(ml\right)\) ( cái này mình nghĩ đề phải là D bạn nhé tại vì khối lượng riêng của HCl là 1,18g/ml )
\(c,m_{MgCl_2}=\left(0,09+0,1\right).95=18,05\left(g\right)\)
\(m_{ddMgCl_2}=6+69,35-0,2=75,15\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{18,05}{75,15}.100\%\approx24,02\%\)

\(a.Mg+2HCl->MgCl_2+H_2\\ MgO+2HCl->MgCl_2+H_2O\\ b.n_{H_2}=\dfrac{2,24}{22,4}=n_{Mg}=0,1mol\\ \%m_{Mg}=\dfrac{0,1.24}{6}=40\%;\%m_{MgO}=60\%\\ n_{MgO}=\dfrac{0,6.6}{40}=0,09\left(mol\right)\\ n_{MgCl_2}=0,1+0,09=0,19\left(mol\right)\\ n_{HCl}=0,19.2=0,38\left(mol\right)\\ V_{ddHCl}=\dfrac{0,38.36,5}{0,2.1,1}=63,0\left(mL\right)\\ C_{M\left(MgCl_2\right)}=\dfrac{0,19}{0,063}=3,0\left(M\right)\)

1)
$MgO + 2HCl to MgCl_2 + H_2O$
$Mg + 2HCl \to MgCl_2 + H_2$
2)
$n_{Mg} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$m_{Mg} = 0,1.24 = 2,4(gam)$
$m_{MgO} = 4,4 - 2,4 = 2(gam)$
3)
$n_{HCl} = 2n_{Mg} + 2n_{MgO} = 0,1.2 + \dfrac{2}{40}.2 = 0,3(mol)$
$V_{dd\ HCl} = \dfrac{0,3}{2} = 0,15(lít) = 150(ml)$

\(a.Mg+2HCl\rightarrow MgCl_2+H_2\\ MgO+2HCl\rightarrow MgCl_2+H_2O\\ b.n_{H_2}=n_{Mg}=0,1\left(mol\right)\\ \Rightarrow m_{Mg}=2,4\left(g\right)\\ \Rightarrow m_{MgO}=4,4-2,4=2\left(g\right)\\ c.\%m_{Mg}=\dfrac{2,4}{4,4}.100=54,55\%\\ \%m_{MgO}=45,45\%\\ d.\Sigma n_{HCl}=2n_{H_2}+2n_{MgO}=0,1.2+\dfrac{2}{40}.2=0,3\left(mol\right)\\ CM_{HCl}=\dfrac{0,3}{2}=0,15\left(l\right)=150ml\)

a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{MgO}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 40y = 4,4 (1)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=x\left(mol\right)\)
⇒ x = 0,1 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{4,4}.100\%\approx54,54\%\\\%m_{MgO}\approx45,46\%\end{matrix}\right.\)
c, Theo PT: \(\Sigma n_{HCl}=2n_{Mg}+2n_{MgO}=0,3\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,3}{2}=0,15\left(l\right)=150\left(ml\right)\)
Bạn tham khảo nhé!

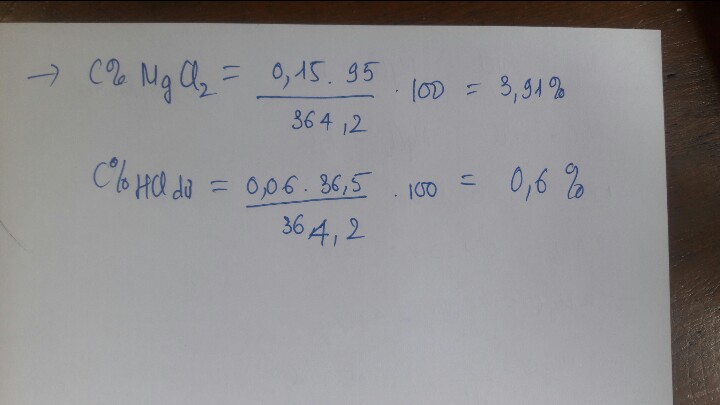
PTHH: Mg + 2HCl \(\rightarrow\) MgCl2 + H2\(\uparrow\) (1)
Theo pt: 1......... 2 ........... 1 ........ 1 ... (mol)
Theo đề: 0,1 ... 0,2 ........ 0,1 ..... 0,1 .. (mol)
PTHH: MgO + 2HCl \(\rightarrow\) MgCl2 + H2O (2)
Theo pt: . 1......... 2 ............ 1 ......... 1 ... (mol)
Theo đề: 0,09 ... 0,18 ...... 0,09 .... 0,09 . (mol)
1/ \(n_{H_2}=\dfrac{V_{đktc}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(m_{Mg}=n.M=0,1.24=2,4\left(g\right)\)
Ta có: mMg + mMgO = 6 (gt)
\(\Rightarrow\) mMgO = 6 - mMg = 6 - 2,4 = 3,6 (g)
\(\%m_{Mg}=\dfrac{m_{Mg}}{m_{hh}}.100\%=\dfrac{2,4}{6}.100\%=40\%\)
\(\%m_{MgO}=\dfrac{m_{MgO}}{m_{hh}}.100\%=\dfrac{3,6}{6}.100\%=60\%\)
2/ \(n_{MgO}=\dfrac{m}{M}=\dfrac{3,6}{40}=0,09\left(mol\right)\)
\(n_{HCl}=n_{HCl\left(1\right)}+n_{HCl\left(2\right)}=0,2+0,18=0,38\left(mol\right)\)
\(m_{HCl}=n.M=0,38.36,5=13,87\left(g\right)\)
\(m_{ddHCl}=\dfrac{m_{HCl}.100\%}{C\%}=\dfrac{13,87.100\%}{20\%}=69,35\left(g\right)\)
\(V_{ddHCl}=\dfrac{m_{ddHCl}}{D}=\dfrac{69,35}{1,12}\approx61,92\left(ml\right)\approx0,062\left(l\right)\)
3/ \(m_{MgCl_2}=m_{MgCl_{2\left(1\right)}}+m_{MgCl_{2\left(2\right)}}=95\left(0,1+0,09\right)=18,05\left(g\right)\)
\(m_{H_2}=n.M=0,1.2=0,2\left(g\right)\)
\(m_{ddspứ}=m_{Mg}+m_{MgO}+m_{ddHCl}-m_{H_2}=6+69,35-0,2=75,15\left(g\right)\)
\(C\%_{MgCl_2}=\dfrac{m_{MgCl_2}}{m_{ddspứ}}.100\%=\dfrac{18,05}{75,15}.100\%\approx24,02\%\)