Bài 1.Đốt cháy hết 2.4 gam một kim loại R thì thu được 4 g oxit. Xác định R và CTHH
Bài 2.Đốt cháy hoàn toàn 7.84 lit CO và H2 (đktc) sau p/ư thu được 10.2 gam hỗn hợp CO2 và H2O. Tính %V của mỗi chất trong hỗn hợp ban đầu.

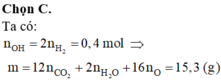
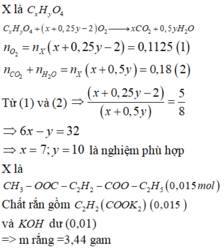
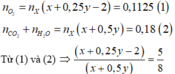
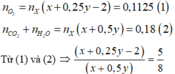
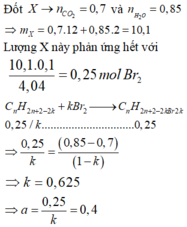
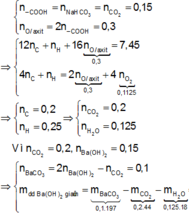


Bài 1.
Gọi n là hóa trị của kim loại R chưa rõ hóa trị
\(4R\left(\dfrac{8}{2R+16n}\right)+nO_2-t^o->2R_2O_n\left(\dfrac{4}{2R+16n}\right)\)
\(n_{R_2O_n}=\dfrac{4}{2R+16n}\left(mol\right)\)
Theo PTHH, ta có: \(n_R=\dfrac{8}{2R+16n}\left(mol\right)\)
\(n_R=\dfrac{2,4}{R}\left(mol\right)\)
\(\Rightarrow\dfrac{2,4}{R}=\dfrac{8}{2R+16n}\)
\(\Leftrightarrow8R=4,8R+38,4n\)
\(\Rightarrow R=12n\)
R là Magie. CTHH của oxit: MgO
Bài 1 : CTHH dạng TQ của oxi kim loại R là RxOy
PTHH :
2xR + yO2 \(\underrightarrow{t^o}\) 2RxOy
Theo ĐLBTKL:
mR + mO2 = mRxOy
\(\Rightarrow\) 2,4 + mO2 = 4 \(\Rightarrow\) mO2 = 4 -2,4 = 1,6(g)
=> nO2 = 1,6/32 = 0,05(mol)
Theo PT : nR = 2x/y . nO2 = 2x/y . 0,05 = 0,1x/y (mol)
=> MR = m/n = 2,4 : 0,1x/y = 24y/x
Biện luận thay x , y =1,2,3.... thấy chỉ có x=y=1 thỏa mãn
=> MR = 24 (g)
=> R là kim loại Magie (Mg)