Có 50 gam dung dịch Fe(NO3)2 20,08%. Làm lạnh dung dịch thấy tách ra 10,1 gam tinh thể hydrat hóa. Dung dịch nước lọc còn lại có nống độ Fe(NO3)2 là 10%. Xác định công thức tinh thể hydrat hóa
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$n_{Fe(NO_3)_3} = \dfrac{29.41,724\%}{242} = 0,05(mol)$
$m_{dd\ sau\ tách\ tinh\ thể} = 29 - 8,08 = 20,92(gam)$
$n_{Fe(NO_3)_3\ sau\ tách\ tinh\ thể} = \dfrac{20,92.34,704\%}{242} = 0,03(mol)$
$\Rightarrow n_{Fe(NO_3)_3.nH_2O} = 0,05 - 0,03 = 0,02(mol)$
$\Rightarrow M_{Fe(NO_3)_3.nH_2O} = 242 + 18n = \dfrac{8,08}{0,02} = 404$
$\Rightarrow n = 9$
Vậy CT của tinh thể là $Fe(NO_3)_3.9H_2O$

Ta có: \(n_{CuO}=\dfrac{10}{80}=0,125\left(mol\right)\)
PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
____0,125___0,125____0,125 (mol)
Ta có: \(m_{H_2SO_4}=0,125.98=12,25\left(g\right)\Rightarrow m_{ddH_2SO_4}=\dfrac{12,25}{24,5\%}=50\left(g\right)\)
⇒ m dd sau pư = 10 + 50 = 60 (g)
- Sau khi làm lạnh: m dd = 60 - 15,625 = 44,375 (g)
\(\Rightarrow m_{CuSO_4\left(saulamlanh\right)}=44,375.22,54\%=10\left(g\right)\)
\(\Rightarrow n_{CuSO_4\left(saulamlanh\right)}=\dfrac{10}{160}=0,0625\left(mol\right)\)
Gọi CTHH của T là CuSO4.nH2O
⇒ nT = 0,125 - 0,0625 = 0,0625 (mol)
\(\Rightarrow M_T=\dfrac{15,625}{0,0625}=250\left(g/mol\right)\)
\(\Rightarrow160+18n=250\Rightarrow n=5\)
Vậy: CTHH của T là CuSO4.5H2O

a) Vì: mA < 400 (g) nên phải có khí thoát ra → muối có dạng MHSO4 và khí là: CO2
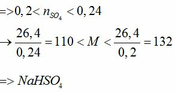
b)
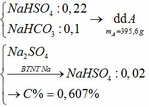
c) Tác dụng được với: MgCO3, Ba(HSO3)2, Al2O3, Fe(OH)2, Fe, Fe(NO3)2
Pt: 2NaHSO4 + MgCO3 → Na2SO4 + MgSO4 + CO2↑ + H2O
2NaHSO4 + Ba(HSO3)2 → BaSO4 + Na2SO4 + SO2↑ + 2H2O
6NaHSO4 + Al2O3 → 3Na2SO4 + Al2(SO4)3 + 3H2O
2NaHSO4 + Fe(OH)2 → Na2SO4 + FeSO4 + 2H2O
2NaHSO4 + Fe → Na2SO4 + FeSO4 + H2↑
12NaHSO4 + 9Fe(NO3)2 → 5Fe(NO3)3 + 2Fe2(SO4)3 + 6Na2SO4 + 3NO↑ + 6H2O

Gọi mH2O(bay hơi) = (g)
\(m_{Fe\left(NO_3\right)_3}=\dfrac{500.10}{100}=50\left(g\right)\)
=> \(C\%\left(ddsaukhibayhoi\right)=\dfrac{50}{500-a}.100\%=25\%\)
=> a = 300(g)

$n_{CuO} = 0,2(mol)$
\(CuO+H_2SO_4\text{→}CuSO_4+H_2O\)
0,2 0,2 0,2 (mol)
$m_{dd\ H_2SO_4} = \dfrac{0,2.98}{20\%} = 98(gam)$
$m_{dd\ A} =16 + 98 = 114(gam)$
Gọi $n_{CuSO_4.5H_2O} = a(mol)$
Sau khi tách tinh thể :
$n_{CuSO_4} = 0,2 - a(mol)$
$m_{dd} = 114 - 250a(gam)$
Suy ra:
$\dfrac{(0,2 - a).160}{114 - 250a} = \dfrac{17,4}{17,4 + 100}$
$\Rightarrow a = 0,1228(mol)$
$m = 0,1228.250 = 30,7(gam)$

1) \(n_{Fe\left(NO_3\right)_3.6H_2O}=n_{Fe\left(NO_3\right)_3}=0,5.0,1=0,05\left(mol\right)\)
`=>` \(m_{Fe\left(NO_3\right)_3.6H_2O}=0,05.350=17,5\left(g\right)\)
2) \(m_{C\text{uS}O_4}=600.10\%=60\left(g\right)\)
Gọi \(n_{C\text{uS}O_4.5H_2O}=a\left(mol\right)\)
`=>` \(\left\{{}\begin{matrix}m_{C\text{uS}O_4\left(t\text{á}ch.ra\right)}=160a\left(g\right)\\m_{C\text{uS}O_4.5H_2O\left(t\text{á}ch.ra\right)}=250a\left(g\right)\end{matrix}\right.\)
`=>` \(\left\{{}\begin{matrix}m_{C\text{uS}O_4\left(c\text{ò}n.l\text{ại}\right)}=60-160a\left(g\right)\\m_{\text{dd}\left(c\text{ò}n.l\text{ại}\right)}=600-400-250a=200-250a\left(g\right)\end{matrix}\right.\)
`=>` \(C\%_{C\text{uS}O_4\left(b\text{ã}o.h\text{òa}\right)}=\dfrac{60-160a}{200-250a}.100\%=20\%\)
`=>` \(a=\dfrac{2}{11}\left(mol\right)\)
`=>` \(m_{tinh.th\text{ể}.C\text{uS}O_4.5H_2O}=\dfrac{2}{11}.250=\dfrac{500}{11}\left(g\right)\)

a/ CT oxit: $CuO$
b/ Vậy CT X: $CuSO_4.5H_2O$
Giải thích các bước giải:
Gọi công thức oxit là: $MO$
Số mol oxit là a mol
$MO+H_2SO_4\to MSO_4+H_2O$
Theo PTHH
$n_{H_2SO_4}=n_{MSO_4}=n_{MO}=a\ mol$
$⇒m_{dd\ H_2SO_4}=\dfrac{98a.100}{24,5}=400a$
$⇒m_{dd\ A}=a.(M+16)+400a = aM+416a$
$m_{MSO_4}=a.(M+96)$
Do nồng độ muối là 33,33% nên:
$\dfrac{a.(M+96)}{aM+416a}.100\%=33,33\\⇒M=64$
Vậy M là Cu, công thức oxit: $CuO$
b.
Trong 60 gam dung dịch muối A có:
$m_{CuSO_4}=\dfrac{60.33,33}{100}=20g$
Gọi công thức tinh thể tách ra là: $CuSO_4.nH_2O$
Khối lượng dung dịch còn lại là:
$60-15,625=44,375g ⇒ m_{CuSO_4\ trong\ dd}=\dfrac{44,375.22,54}{100}=10g$
$⇒m_{CuSO_4\ trong\ tinh\ thể}=20-10=10g$
$⇒n_{tinh\ thể}=n_{CuSO_4}=0,0625\ mol$
$⇒M_{tinh\ thể}=15,625:0,0625=250⇒n=5$
Vậy CT X: $CuSO_4.5H_2O$
CTTQ: Fe(NO3)2.xH2O
m\(Fe\left(NO_3\right)_2\) = (50.20,08%)/100% = 10,04(g)
m\(Fe\left(NO_3\right)_2\) (sau khi làm lạnh) = 50 - 10,1 = 39,9 (g)
m\(Fe\left(NO_3\right)_2\) (sau khi làm lạnh) =(39,9.10%)/100%=3,99 (g)
m\(Fe\left(NO_3\right)_2\) (tách ra) = 10,04 - 3,99 = 6,05 (g)
=> CT của tinh thể: Fe(NO3)2.7H2O
Ta có tỉ lệ
180/(180+18x) = 6,05/10,1
Giải ra ta được x = 6,67 = 7