Thổi từ từ V lít hỗn hợp khí (đktc) gồm CO và H2 đi qua một ống đựng 16,8 gam hỗn hợp 3 oxit: CuO, Fe3O4, Al2O3 nung nóng, phản ứng hoàn toàn. Sau phản ứng thu được m gam chất rắn và một hỗn hợp khí và hơi nặng hơn khối lượng của hỗn hợp V là 0,32 gam. Tính V và m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D.
Ta có: mO = 0,32 (g) ⟹ nO = 0 , 32 16 = 0,02 (mol) nên số mol của hỗn hợp CO, H2 cũng bằng 0,02 (mol) ⟹ V = 0,02.22,4 = 0,448 (l).
Theo định luật bảo toàn khối lượng, m = 16,8 – 0,02.16 = 16,48 (g).

Ta có thể tổng quát các phản ứng như sau:
![]()
Quan sát 2 phản ứng trên, ta nhận thấy: khối lượng hỗn hợp khí và hơi thu được sau phản ứng nặng hơn hỗn hợp CO, H2 ban đầu là do H2, CO đã "chiếm lấy" những nguyên tử O trong oxit.
Khi đó khối lượng hỗn hợp khí tăng lên chính là khối lượng mà chất rắn đã giảm đi sau phản ứng hay khối lượng này chính là khối lượng của những nguyên tử oxi trong oxit bị "chiếm mất".
Suy ra m c h ấ t r ắ n p h ả n ứ n g - m o x i b a n đ ầ u - 0 , 32 = 16 , 48 ( g a m )
Cũng quan sát các phản ứng hoặc sử dụng định luật BTNT đối với C, H, có:
![]()
Đáp án B.

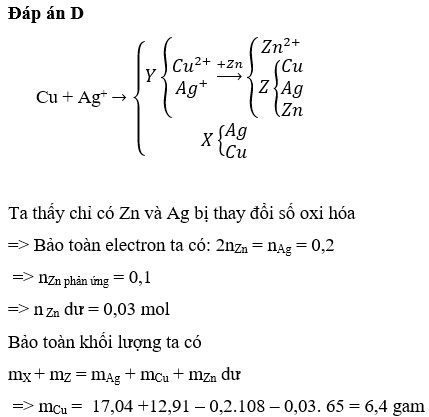
Đáp án A
Vì khi cho chất rắn thu được sau phản ứng với CO tác dụng với dung dịch HCl tạo ra khí H2 nên R phải là kim loại đứng sau Al và đứng trước hidro trong dãy hoạt động hóa học. Đặt công thức oxit của R là RxOy.
CuO + CO → Cu + CO2
a a
RxOy + y CO → x R + y CO2
c xc
Al2O3 + 6 HCl → 2 AlCl3 + 3 H2O
b 6b
R + n HCl → RCln + n/2 H2
xc nxc xc nxc/2
Đặt số mol của CuO, Al2O3, RxOy trong 6,1 gam hỗn hợp A lần lượt là a, b và c. Ta có:
80 a + 102 b + ( x M R + 16 y ) c = 6 , 1 ( 1 ) 1 , 28 + 102 b + M R x c = 4 , 28 ( 2 ) 64 a = 1 , 28 ( 3 ) 6 b + n x c = 0 , 15 ( 4 ) n x c / 2 = 0 , 045 ( 5 ) ( 3 ) ⇒ a = 0 , 02 ( 5 ) ⇒ n c x = 0 , 09 ( 6 ) ( 4 ) ⇒ b = 0 , 01 ( 2 ) ⇒ M R = 28 n ⇒ n = 2 ; M R = 56 , R l à F e ( 6 ) ⇒ x c = 0 , 045 ( 1 ) ⇒ y c = 0 , 06 ⇒ x y = 0 , 045 0 , 06 = 3 4 ⇒ x = 3 ; y = 4
Công thức oxit là Fe3O4.

1) \(\left\{{}\begin{matrix}n_{CO}+n_{CO_2}=\dfrac{3,136}{22,4}=0,14\left(mol\right)\\\dfrac{28.n_{CO}+44.n_{CO_2}}{n_{CO}+n_{CO_2}}=16.2=32\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{CO}=0,105\left(mol\right)\\n_{CO_2}=0,035\left(mol\right)\end{matrix}\right.\)
nO = nCO2 = 0,035 (mol)
=> a = 2,92 + 0,035.16 = 3,48(g)
\(n_{H_2SO_4}=\dfrac{100.5,39\%}{98}=0,055\left(mol\right)\)
nH2O = nO = 0,035 (mol)
Bảo toàn H: \(n_{H_2}=\dfrac{0,055.2-0,035.2}{2}=0,02\left(mol\right)\)
=> \(V=0,02.22,4=0,448\left(l\right)\)
2) Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Fe_3O_4}=b\left(mol\right)\\n_{CuO}=c\left(mol\right)\end{matrix}\right.\)
=> 56a + 232b + 80c = 3,48 (1)
Bảo toàn Fe: nFe = a + 3b (mol)
Bảo toàn Cu: nCu = c (mol)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,02<-0,02<------0,02<---0,02
Fe3O4 + 4H2SO4 --> Fe2(SO4)3 + FeSO4 + 4H2O
b--->4b------------>b-------------->b
CuO + H2SO4 --> CuSO4 + H2O
c---->c------------>c
=> a = 0,02
=> 0,02 + 4b + c = 0,055 => 4b + c = 0,035
(1) => 232b + 80c = 2,36
=> b = 0,005 (mol); c = 0,015 (mol)
B chứa \(\left\{{}\begin{matrix}FeSO_4:0,025\left(mol\right)\\Fe_2\left(SO_4\right)_3:0,005\left(mol\right)\\CuSO_4:0,015\left(mol\right)\end{matrix}\right.\)
mdd sau pư = 3,48 + 100 - 0,02.2 = 103,44 (g)
=> \(\left\{{}\begin{matrix}C\%_{FeSO_4}=\dfrac{0,025.152}{103,44}.100\%=3,674\%\\C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{0,005.400}{103,44}.100\%=1,933\%\\C\%_{CuSO_4}=\dfrac{0,015.160}{103,44}.100\%=2,32\%\end{matrix}\right.\)
3)
Rắn khan chứa \(\left\{{}\begin{matrix}BaSO_4\\Fe\left(OH\right)_3\\Cu\left(OH\right)_2\end{matrix}\right.\)
Có: \(n_{BaSO_4}=n_{SO_4}=0,055\left(mol\right)\)
Bảo toàn Fe: \(n_{Fe\left(OH\right)_3}=n_{FeSO_4}+2.n_{Fe_2\left(SO_4\right)_3}=0,035\left(mol\right)\)
Bảo toàn Cu: \(n_{Cu\left(OH\right)_2}=0,015\left(mol\right)\)
=> b = 0,055.233 + 0,035.107 + 0,015.98 = 18,03 (g)
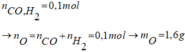

[VIết phương trình hóa học ra]
(Al2O3 không bị khử bởi CO và H2 ở nhiệt độ cao)
Ta thấy, trong quá trình phản ứng thì hai oxit bị khử mất đi ngyên tử oxi trong công thức phân tử tạo thành kim loại.
Và khí sinh ra sau phản ứng theo đề cho nặng hơn khối lượng hỗn hợp khí ban đầu là 0,32 gam.
=> 0,32 gam này là khối lượng của nguyên tử oxi có trong 2 oxit bị khử là CuO và Fe3O4
=> Khối lượng chất rắn thu được sau phản ứng là:
\(m chất rắn = 16,8 - 0,32 = 16,48(g)\)
Vậy \(m = 16,48 (g)\)
Ta có: \(n_{hh}=n_O=\dfrac{0,32}{16}=0,02\left(mol\right)\)
\(\Rightarrow V\left(đktc\right)=0,448\left(l\right)\)