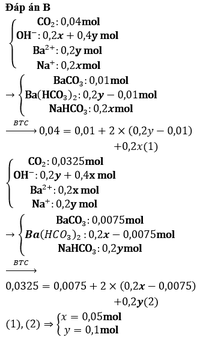
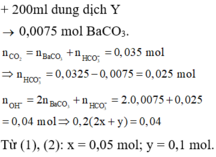cho 0.05 mol co2 hấp thụ hoàn toàn vào 500ml dung dịch ba(oh)2 (dung dịch a) thì thu được m gam kết tủa. Nếu cho 0.35 mol CO2 hấp thụ hoàn toàn vào 500ml dung dịch A thì cũng thu được m gam kết tửa, xác định m và tính Cm của dung dịch A
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn D
nCO2 dùng ở 2 thí nghiệm là như nhau nhưng TN2 cho nhiều BaCO3 hơn TN1
Þ Trong dung dịch sau phản ứng của TN1 còn Ba2+ cùng với CO32− hoặc HCO3-
Þ Dung dịch sau phản ứng của TN1 chỉ có Ba(HCO3)2.
Vậy ở TN1 bản chất là giống thí nghiệm 1 tạo ra 0,1 mol BaCO3 và dung dịch có a – 0,1 mol Ba(HCO3)2
Lượng NaOH thêm vào là a > nBa(HCO3)2 Þ Toàn bộ Ba2+ đã kết tủa
Þ a – 0,1 = 0,1 Þ a = 0,2; BTNT.C Þ nCO2 = 0,1 + 0,1.2 = 0,3 Þ V = 6,72.

Đáp án A
Có nCO2 = 0,07 mol ; nNaOH= 0,08 mol
=> nCO32-=0,01 mol ; nHCO3- = 0,06 mol
Y gồm 0,04 mol BaCl2 ; 0,25a mol Ba(OH)2
=>để tạo 3,94 g kết tủa hay 0,02 mol BaCO3 th́ HCO3- + OH- → CO32-
0,01 <- 0,01(mol)
=> 0,5a=0,01 => a=0,02M

Ba(OH)2 + CO2 -> BaCO3 + H2O (1)
BaCO3 + CO2 + H2O -> Ba(HCO3)2 (2)
TN1: 2,464 lít CO2 (đktc) vào 200ml dung dịch X thì thu được 3a gam kết tủa.
TN2: 3,136 lít CO2 (đktc) vào 200ml dung dịch X thì thu được 2a gam kết tủa
=> Lượng CO2 ở TN2 tăng mà kết tủa lại giảm
*TN1: Chỉ xảy ra (1)
nCO2 = 0,11 mol
nBa(OH)2 = 0,2x mol
=> nBaCO3 (1) = 0,2 x mol
=> 3a = 0,2x . 197 = 39,2 x (I)
* TN2: Xảy ra cả (1)(2)
nCO2 = 0,14 mol
=> nCO2 (2) = 0,14 - 0,11 = 0,3 mol
=> nBaCO3 (2) = 0,3 mol
=> nBaCO3 còn lại = 0,2 x - 0,3 mol
=> 2a = (0,2 x - 0,3).197 = 39,2x - 59,1
=> 3a = (39,2x - 59,1). 1,5 = 58,8x - 88,65 (II)
Từ (I) và (II) => 39,2 x = 58,8x - 88,65
=> x = 4,5 M

Đáp án B
Do dd M và dd N đều tác dụng với KHSO4 sinh ra kết tủa nên dd M và dd N đều chứa Ba(HCO3)2
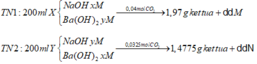


Vì lượng CO2 thay đổi mà lượng kết tủa vẫn giữ nguyên nên:
Khi sục a mol CO2 thì Ca(OH)2 dư, khi sục 1,5 mol CO2 thì CaCO3 bị hoà tan một phần
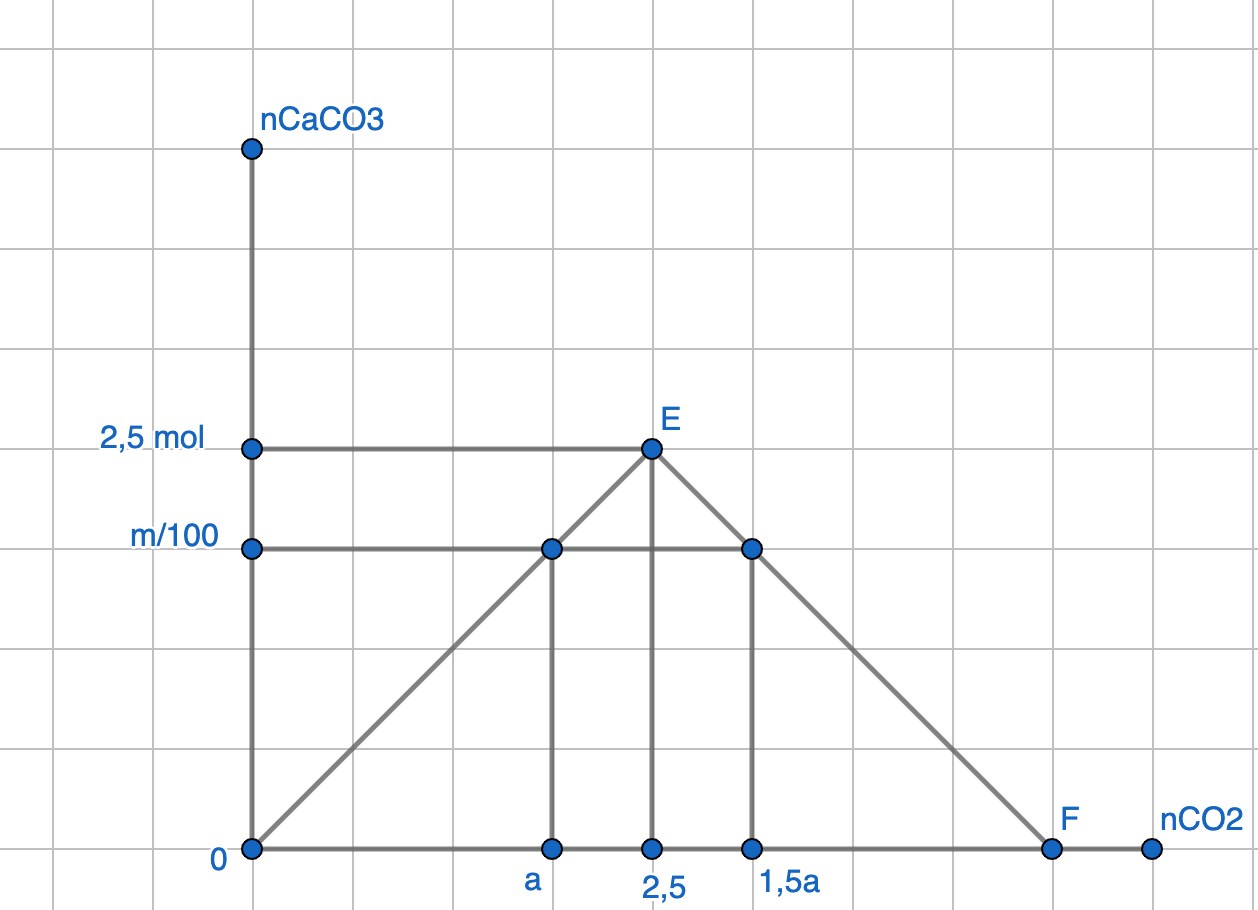
từ đồ thị suy ra: a = 2,5 .2 / 2,5 = 2 (mol)
=> m = 200g