Hỗn hợp X gồm NaNO3, Fe(NO3)2 và Mg(NO3)2 trong đó số mol Mg(NO3)2 bằng hai lần số mol Fe(NO3)2. Nung nóng m gam X (trong điều kiện không có oxi) để phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y. Hấp thụ toàn bộ Y vào nước thu được 1,2 lít dung dịch Z (chỉ chứa một chất tan duy nhất) có pH = 1. Giá trị của m là
A. 28,96. B. 12,130. C. 10,37. D. 21,25.
Mình cần lời giải nữa ạ

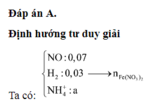
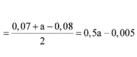
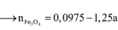

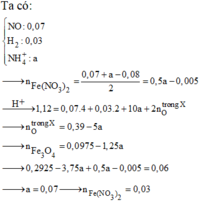

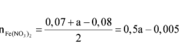

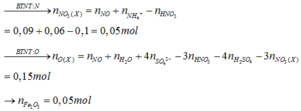
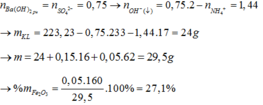

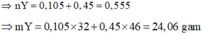
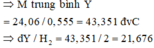
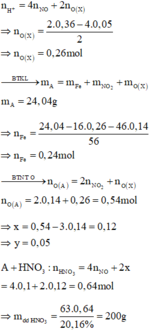
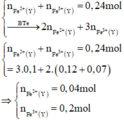
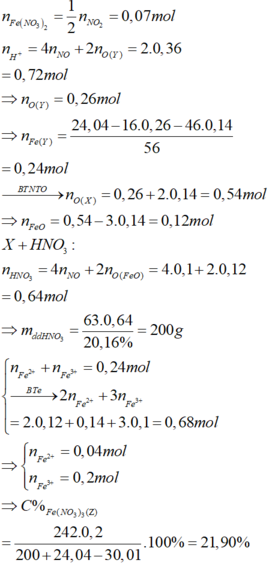
Đáp án C
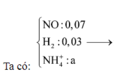
Đặt số mol Fe là a , Mg là 2a , Na là b
Bảo toàn N : 2nFe(NO3)2 + 2nMg(NO3)2 = nHNO3
<=>6a = 1,2.0,1
<=> a=0,02
2NaNO3 ➝ 2NaNO2 + O2
b ➝ \(\dfrac{b}{2}\)
2Mg(NO3)2 ➝ 2MgO + 4NO2 +O2
0,04 ➝ 0,02
2Fe(NO3)2 ➝ 2FeO + 4NO2 + O2
0,02 ➝ 0,01
4FeO + O2 ➝ 2Fe2O3
0,02 ➝ 0,005
2H2O + 4NO2 + O2 ➝ 4HNO3
0,03 ← 0,12
=> 0,01 + 0,02 - 0,005 + \(\dfrac{b}{2}\) = 0,03
<=> b= 0,01
=> m = 0,01.85 + 0,02.180 + 0,04.148=10,37