58.91g Ba + {HCl 2.5M và CuSO4 2M} 200ml. mg kết tủa là ? Giúp mình với...
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
nNa2CO3 = 0,2.2 = 0,4 mol = nBaCO3
=> mBaCO3 = 0,4.197 = 78,8 gam
b) BaCO3 + 2HCl → BaCl2 + CO2 + H2O
Theo tỉ lệ phản ứng => nHCl cần dùng = 2nBaCO3 = 0,4.2 =0,8 mol
=>mHCl = 0,8.36,5 = 29,2 gam
<=> mdung dịch HCl 30% cần dùng = \(\dfrac{29,2}{30\%}\)= 97,3 gam

n Ba(OH)2 = 2.0,2=0,4 mol
\(Ba\left(OH\right)_2+SO_2->BaSO_3+H_2O\)
0,4 ................0,4...........0,4
m BaSO3 = 0,4. ( 138+32+16.3)=87,2 g
v SO2 = 0,4.22,4=8,96 lít
m BaSO3 = 0,4. ( 137+32+16.3)=86,8 g
xin lũi nha mình nhìn nhầm bạn thông cảm

PTHH: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\) (1)
\(HCl+NaOH\rightarrow NaCl+H_2O\) (2)
\(AlCl_3+3NaOH\rightarrow3NaCl+Al\left(OH\right)_3\downarrow\) (3)
Ta có: \(\left\{{}\begin{matrix}n_{Al_2O_3}=\dfrac{6,12}{102}=0,06\left(mol\right)\\\Sigma n_{HCl}=0,2\cdot2=0,4\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,06}{1}< \dfrac{0,4}{6}\) \(\Rightarrow\) HCl còn dư, Al2O3 p/ứ hết
Vì bazơ mạnh sẽ p/ứ với axit mạnh trước nên sẽ xảy ra p/ứ (2) và (3)
Lại có: \(n_{Al\left(OH\right)_3}=\dfrac{7,8}{78}=0,1\left(mol\right)=n_{AlCl_3\left(3\right)}\)
Theo PTHH (1): \(n_{AlCl_3\left(1\right)}=0,12\left(mol\right)\)
\(\Rightarrow\) AlCl3 còn dư nên tính theo Al(OH)3 \(\Rightarrow n_{NaOH\left(3\right)}=0,3\left(mol\right)\)
Mặt khác: \(n_{HCl\left(dư\right)}=n_{HCl\left(2\right)}=0,04\left(mol\right)=n_{NaOH\left(2\right)}\)
\(\Rightarrow\Sigma n_{NaOH}=0,34\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,34}{2}=0,17\left(l\right)=170\left(ml\right)\)

HCl + AgNO3 ➜ AgCl↓ + HNO3
\(n_{HCl}=0,2\times2=0,4\left(mol\right)\)
\(n_{AgNO_3}=0,3\times2=0,6\left(mol\right)\)
Theo PT: \(n_{HCl}=n_{AgNO_3}\)
Theo bài: \(n_{HCl}=\dfrac{2}{3}n_{AgNO_3}\)
Vì \(\dfrac{2}{3}< 1\) ⇒ dd HCl hết, dd AgNO3 dư
Theo PT: \(n_{AgCl}=n_{HCl}=0,4\left(mol\right)\)
\(\Rightarrow m_{AgCl}=0,4\times143,5=57,4\left(g\right)\)
Dung dịch B gồm: AgNO3 dư và HNO3
Theo PT: \(n_{AgNO_3}pư=n_{HCl}=0,4\left(mol\right)\)
\(\Rightarrow n_{AgNO_3}dư=0,6-0,4=0,2\left(mol\right)\)
Theo PT: \(n_{HNO_3}=n_{HCl}=0,4\left(mol\right)\)
\(\Sigma n_{ctB}=n_{AgNO_3}dư+n_{HNO_3}=0,2+0,4=0,6\left(mol\right)\)
\(\Sigma m_{ddB}=0,2+0,3=0,5\left(l\right)\)
\(\Rightarrow C_{M_{ddB}}=\dfrac{0,6}{0,5}=1,2\left(M\right)\)
HCl + AgNO3 ➜ AgCl↓ + HNO3
\(n_{HCl}=0,2\times2=0,4\left(mol\right)\)
\(n_{AgNO_3}=0,3\times2=0,6\left(mol\right)\)
Theo PT: \(n_{HCl}=n_{AgNO_3}\)
Theo bài: \(n_{HCl}=\dfrac{2}{3}n_{AgNO_3}\)
Vì \(\dfrac{2}{3}< 1\) ⇒ dd HCl hết, dd AgNO3 dư
Theo PT: \(n_{AgCl}=n_{HCl}=0,4\left(mol\right)\)
\(\Rightarrow m_{AgCl}=0,4\times143,5=57,4\left(g\right)\)
Dung dịch B gồm: AgNO3 dư và HNO3
\(\Sigma m_{ddB}=0,2+0,3=0,5\left(l\right)\)
Theo PT: \(n_{HNO_3}=n_{HCl}=0,4\left(mol\right)\)
Theo PT: \(n_{AgNO_3}pư=n_{HCl}=0,4\left(mol\right)\)
\(\Rightarrow n_{AgNO_3}dư=0,6-0,4=0,2\left(mol\right)\)
\(\Sigma n_{ctB}=n_{AgNO_3}dư+n_{HNO_3}=0,2+0,4=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{ddB}}=\dfrac{0,6}{0,5}=1,2\left(M\right)\)

Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
\(n_{BaSO_4}=\dfrac{11,65}{233}=0,05\left(mol\right)\)
\(Mg+CuSO_4\rightarrow MgSO_4+Cu\)
x------>x--------->x------------>x
\(2Al+3CuSO_4\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
y------>1,5y-------->0,5y-------->1,5y
Có hệ \(\left\{{}\begin{matrix}24x+27y=0,78\\x+1,5y=\dfrac{2,56}{64}\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
Giả sử \(CuSO_4\) phản ứng hết, dung dịch C có: \(\left\{{}\begin{matrix}n_{MgSO_4}=x=0,01\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,5y=0,5.0,02=0,01\left(mol\right)\end{matrix}\right.\)
\(MgSO_4+BaCl_2\rightarrow MgCl_2+BaSO_4\) (1)
0,01-------------------------------->0,01
\(Al_2\left(SO_4\right)_3+3BaCl_2\rightarrow3BaSO_4+2AlCl_3\) (2)
0,01------------------------>0,03
Từ PTHH (1), (2) có: \(\Sigma n_{BaSO_4}=0,01+0,03=0,04\left(mol\right)< 0,05\left(mol\right)_{theo.đề}\)
=> Giả sử sai, \(CuSO_4\) dư
\(CuSO_4+BaCl_2\rightarrow BaSO_4+CuCl_2\)
0,01<-----------------0,01
\(CM_{CuSO_4}=a=\dfrac{x+1,5y+0,01}{0,2}=\dfrac{0,01+1,5.0,02+0,01}{0,2}=0,25\left(M\right)\)
Trong A:
\(n_{Al}=0,02\left(mol\right)\\ n_{Mg}=0,01\left(mol\right)\)

Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g


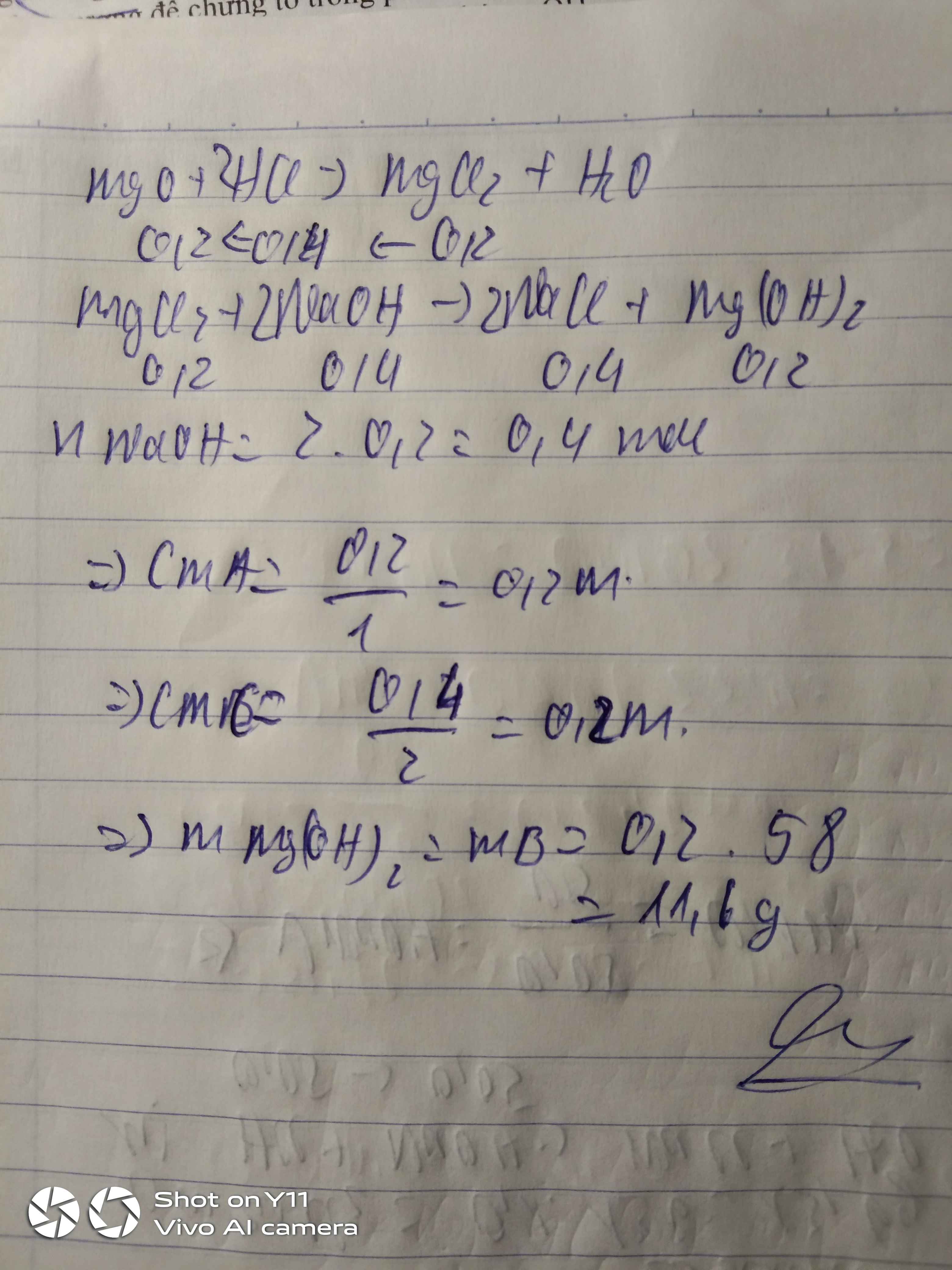
nBa=0,43mol
Số mol HCl=0,5mol
Số mol CuSO4=0,4mol
Ba+2HCl\(\rightarrow\)BaCl2+H2
Dựa vào số mol và hệ số cân bằng ta thấy HCl hết, Ba dư=0,43-0,5:2=0,18mol
Số mol BaCl2=0,5:2=0,25mol
Ba+2H2O\(\rightarrow\)Ba(OH)2+H2
Số mol Ba(OH)2=số mol Ba=0,18mol
Ba(OH)2+CuSO4\(\rightarrow\)BaSO4\(\downarrow\)+Cu(OH)2\(\downarrow\)
Số mol BaSO4=số mol Cu(OH)2=0,18mol
Số mol CuSO4dư=0,4-0,18=0,22mol
BaCl2+CuSO4\(\rightarrow\)BaSO4\(\downarrow\)+CuCl2
Số mol BaSO4=số mol CuSO4 dư=0,22mol
mkết tủa=(0,18+0,22).233+0,18.98=110,84g