cho 14,4 g hỗn hợp gồm Fe và một oxit sắt có số mol = nhau vào H2SO4 đặc nóng dư thu được 2,24 lít SO2(đktc). Xác định công thức oxit sắt.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


2Fe + 6H2SO4 (đ,n) => Fe2(SO4)3 + 3SO2 + 6H2O
Gọi CT oxit sắt là: FexOy.
2FexOy + (6x-2y) H2SO4 => xFe2(SO4)3 + (3x-2y)SO2 + (6x-2y)H2O
nSO2 = V/22.4 = 2.24/22.4 = 0.1 (mol)
Gọi n (mol) là số mol của Fe
Mà theo đề bài: nFe = nFexOy => nFexOy = n
Ta có: 1.5n + (3x-2y)n/2 = 0.1 (1)
56n + (56x + 16y)n = 14.4 (2)
Các CT oxit sắt: FeO; Fe2O3;Fe3O4
Nếu x=1, y=1: thế vào phương trình (1)
=> n = 0.05 (mol)
Thế vào phương trình (2) => n = 0.1125
==> Loại
Nếu x=2; y=3; thế vào phương trình (1)
=> n = 0.0(6)
Thế vào phương trình (2) => n = 0.0(6)
==> Nhận
Nếu x=3; y=4; thế vào phương trình (1)
=> n = 0.05;
Thế vào phương trình (2) => n = 0.05
==> Nhận...
...

Chọn đáp án B
Bài toán khá đơn giản khi axit đã cho dư nên muối là Fe3+.
Và
![]()
=0,2.3+0,1=0,7(mol)

a)Gọi công thức oxit sắt:FexOy
2FexOy+(6x-2y)H2SO4=>xFe2(SO4)3+(3x-2y)...
_Muối thu được sau phản ứng là Fe2(SO4)3:
=>nFe2(SO4)3=120/400=0.3(mol)
nSO2=2.24/22.4=0.1(mol)
=>nSO2/nFe2(SO4)3=3x-2y/ x=0.1/0.3
<=>0.3(3x-2y)=0.1x
<=>0.6y=0.8x
<=>x/y=3/4
Vậy công thức oxit sắt là Fe3O4.
Viết lại:
2Fe3O4+10H2SO4=>3Fe2(SO4)3+SO2+10H2O
0.2------------------------------>0.3(m...
=>nFe3O4=0.3*2/3=0.2(mol)
=>mFe3O4=a=0.2*232=46.4(g)
b)_Cho CO đi qua Fe3O4 tạo thành Fe và khí CO2:
Fe3O4+4CO=>3Fe+4CO2
0.2------->0.8--->0.6-->0.8(mol)
=>nCO2=0.2*4=0.8(mol)
=>mCO2=0.8*44=35.2(g)
mddNaOH=500*1.25=625(g)
nNaOH=2.2*0.5=1.1(mol)
=>nNaOH/nCO2=1.1/0.8=1.375=>1<1.375<2=>... ra muối trung hòa và muối axit.
_Dung dịch A thu được gồm Na2CO3 và NaHCO3:
Gọi a,b là số mol của CO2 ở (1)(2):
CO2+2NaOH=>Na2CO3+H2O
a------->2a-------->a(mol)
CO2+NaOH=>NaHCO3
b--------->b-------->b(mol)
Ta có:
a+b=0.8
2a+b=1.1
<=>a=0.3,b=0.5
=>mNa2CO3=0.3*106=31.8(g)
=>mNaHCO3=0.5*84=42(g)
_mddsaupư=mCO2+mddNaOH
=35.2+625=660.2(g)
=>C%(Na2CO3)=31.8*100/660.2=4.8%
=>C%(NaHCO3)=42*100/660.2=6.4%



Qui đổi ½ hh B gồm Al (x mol), Fe (y mol), O (z mol)

=> mB = 2 (mAl + mFe + mO) = 102,78g
Gọi công thức của oxit sắt là FeaOb

=> Fe2O3

Đáp án B
Gọi công thức của oxit sắt là FexOy.
Vì hòa tan chất rắn sau phản ứng vào dung dịch NaOH dư có xuất hiện khí nên hỗn hợp sau phản ứng nhiệt nhôm gồm Fe, A12O3 và Al dư.
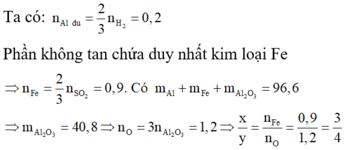

Đáp án A
Ta có sơ đồ phản ứng:
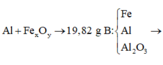
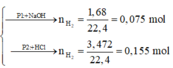
Phần 1:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
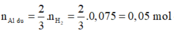
![]()
Phần 2:
2Al + 6HCl → 2AlCl3 + 3H2↑ (1)
0,05 → 0,075
Fe + 2HCl → FeCl2 + H2↑ (2)
![]()
![]()
![]()
![]()
Ta có phương trình phản ứng:
![]()
Khối lượng các chất trong 1 phần hỗn hợp B là 19,82/2 = 9,91 g
![]()
![]()
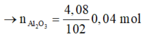
Ta có:
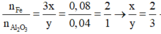
=> Oxit sắt cần tìm là Fe2O3


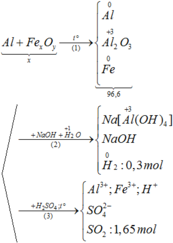
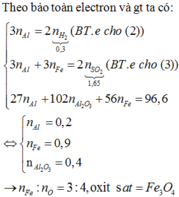
Gọi $n_{Fe} = n_{Fe_2O_n} = a(mol)$
Ta có :$56a + a(112 + 16n) = 14,4(1)$
$n_{SO_2} = 0,1(mol)$
Bảo toàn electron :
$3a + a(3 - n) = 0,1.2(2)$
Từ (1)(2) suy ra : $a = \dfrac{1}{15} ; an = 0,2$
Suy ra: $n = an :a = 3$
Vậy oxit là $Fe_2O_3$
Gọi nFe=nFe2On=a(mol)nFe=nFe2On=a(mol)
Ta có :56a+a(112+16n)=14,4(1)56a+a(112+16n)=14,4(1)
nSO2=0,1(mol)nSO2=0,1(mol)
Bảo toàn electron :
3a+a(3−n)=0,1.2(2)3a+a(3−n)=0,1.2(2)
Từ (1)(2) suy ra : a=115;an=0,2a=115;an=0,2
Suy ra: n=an:a=3n=an:a=3
Vậy oxit là Fe2O3