Hòa tan muối cacbonat của kim loại M bằng 1 lượng vừa đủ dung dịch H2SO4 9.8% thu được muối sunfat có nồng độ 14.18%. Tìm kim loại M
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


tham khảo
Coi mdd H2SO4=100(gam)mdd H2SO4=100(gam)
⇒nH2SO4=100.9,8%98=0,1(mol)⇒nH2SO4=100.9,8%98=0,1(mol)
Gọi CTHH của muối cacbonat kim loại R hóa trị n là R2(CO3)nR2(CO3)n
R2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2OR2(CO3)n+nH2SO4→R2(SO4)n+nCO2+nH2O
Theo phương trình ,ta có :
nCO2=nH2SO4=0,1(mol)nCO2=nH2SO4=0,1(mol)
nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)nR2(SO4)n=nR2(CO3)n=nH2SO4n=0,1n(mol)
Sau phản ứng ,
mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)mdd=0,1n(2R+60n)+100−0,1.44=0,2Rn+101,6(gam)
mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)mR2(SO4)n=0,1n(2R+96n)=0,2Rn+9,6(gam)
⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%⇒C%muối=(0,2Rn+9,6):(0,2Rn+101,6).100%=14,18%
⇒R=28n⇒R=28n
Với n=1n=1 thì R=28R=28(loại)
Với n=2n=2 thì R=56(Fe)R=56(Fe)
Với n=3n=3 thì R=84R=84(loại)
Vậy kim loại R hóa trị n là FeFe hóa trị II

Đáp án A.
Coi nH2SO4 = 1 mol
M(OH)2 + H2SO4 → MSO4 + 2H2O
mdd H2SO4= 1.98.100/20 = 490 (gam)
=> mdd sau = (M + 34) + 490 = M + 524


Đáp án C
Giả sử đem 1 mol H2SO4 phản ứng, ta có:
![]()
mdung dịch sau phản ứng = 490 + (M + 34) (gam)
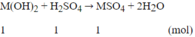
Theo đề bài ta có:
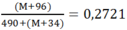
⇒ M = 64: Đồng

Giả sử có 1 mol RCO3
PTHH: RCO3 + 2HCl → RCl2 + CO2↑ + H2O
1 → 2 1 1 1 (mol)
Ta có mdd(sau pứ) = mRCO3+mdd(HCl)−mCO2
⟹ mdd(sau pứ) = \(\dfrac{\text{MR+60+(2.36,5.100%)}}{7,3\%-1,44}\)=MR+1016
⟹ C%(RCl2)=mRCl2mdd(sau).100%=\(\dfrac{M_{R_{ }}+71}{_{ }M_R+1016}\).100%=9,135%
⟹ MR = 24 (Mg)
Vậy công thức của muối là MgCO3.

Giả sử có 100 g dung dịch acid.
\(n_{MO}=n_{MSO_4}=n_{H_2SO_4}=\dfrac{a}{98}\left(mol\right)\\ m_{ddsau}=\dfrac{\left(M+16\right)a}{98}+100=\dfrac{\left(M+96\right)a}{98\cdot\dfrac{b}{100}}=\dfrac{a\left(M+96\right)}{0,98b} \)
\(\dfrac{M+16}{98}+100=\dfrac{M+96}{0,98b}\\ M+16+9800=\dfrac{100M+9600}{b}\\ bM+9816=100M+9600\\ M\left(100-b\right)=216\\ M=\dfrac{216}{100-b}\left(g\cdot mol^{-1}\right)\)

Đáp án A
Hướng dẫn Gọi số mol oxit MO = x mol
MO + H2SO4 ® MSO4 + H2O
(mol): x x x
Ta có: (M + 16)x = a
Khối lượng dung dịch axit H2SO4 ban đầu = ![]() = 560x (gam)
= 560x (gam)
Khối lượng dung dịch sau phản ứng = a + 560x = (M + 16)x + 560x
Theo bài: C% (MSO4) = 20% nên: ![]()
Từ đây tìm được M = 24 (magie). Oxit kim loại cần tìm là MgO
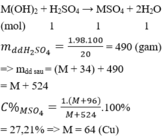
gọi công thức của muối đó là M2(CO3)x với x là hóa trị của kim loại đó
gọi a là số mol của muối đó
M2(CO3)x + xH2SO4 ---> M2(SO4)x + xH2O + xCO2
a mol --- --- ->ax mol --- -->a mol --- --- --- --- --->ax mol
khối lượng H2SO4 tham gia phản ứng là 98ax gam
=> khối lượng dd H2SO4 là 1000ax gam
khối lượng muối cacbonat là a(2M + 60x) gam
khối lượng muối sunfat là a(2M + 96x) gam
khối lượng khí CO2 bay ra là 44ax gam
theo định luật bảo toàn khối lượng, ta có:
khối lượng dd sau phản ứng là
m = a(2M + 60x) + 1000ax - 44ax = 2aM + 1016ax
theo đề ta có:
(2aM + 96ax)/(2aM + 1016ax) = 14,18/100
triệt tiêu a ở vế trái, quy đồng 2 vế rồi biến đổi ta tính được:
M = 28x
kim loại chỉ có 3 hóa trị từ 1 đến 3
ta thay x lần lượt bằng 1, 2, 3 thì ra được kết quả thích hợp là:
x = 2 và M = 56
=> kim loại đó là Fe
=> khối lượng dd H2SO4 là 1000ax gam
cho mình hỏi làm sao suy ra được???